Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
4 participants
Page 1 sur 1
 Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Un thread pour essayer de comprendre ou de spéculer sur l'historique des visions progressives qu'on a pu avoir à travers le temps.
Aide bienvenue car c'est pas forcément facile de résumer et d'identifier les différentes petites marches qui ont mené à notre vision de l’infiniment petit
EDIT 20210512: Amélioration partie chimie
EDIT 20210522: Amélioration partie chimie avec Cavendish + isolation dihydrogène utilisé par Lavoisier + électrolyse
EDIT 20210523: Spectroscopie + tableau périodique
EDIT 20210529: Calcul volume atomique Meyer + erreur dans le spoiler sur la périodicité
Partons d'une situation où on ne connait rien de ce qu'on connait aujourd'hui. Pas de molécules, pas d'atomes, rien.
À notre niveau, on voit assez facilement que certaines choses semblent liquides (eau) et d'autres solides (terre).
Chose intrigante, si on habite prêt d'un cours d'eau qui gèle en hiver, on voit que l'eau peut devenir solide parfois puis refondre au printemps selon la température.
On ne sait pas trop ce qu'une élévation de la température engendre mais les deux états semblent liés à la température.
On en arrive au postulat que ce qui est froid a tendance à être solide, et à une certaine température ça devient liquide.
Ça nous donne 2 états possibles pour un matériau. Par exemple, pour l'eau, glace → eau liquide.
Une autre chose intrigante, c'est l'air dans lequel nous évoluons. On pourrait croire qu'il n'y a rien mais on ne peut s'empêcher de respirer.
On ne voit rien qui rentre dans notre corps, mais nos poumons doivent forcément utiliser quelque chose dans cet "air".
De même, si on souffle sur sa main, on sent un filet qui rappelle l'eau si on met sa main dans le courant d'une rivière.
Puis, un jour, la foudre s'abat sur un arbre et il prend feu. On voit de la fumée qui semble s'élever dans le ciel.
Après plusieurs heures, le feu s'éteint et il reste seulement une sorte de poudre au niveau de l'arbre. La matière semble avoir disparu en grande partie ainsi que le feu et la fumée.
Pourtant, ça ne sent pas bon... Il y a une odeur acre partout et très loin autour du feu, comme si ce qui donne l'odeur s'était "étalé" partout.
Il semble donc y avoir une substance nouvelle dans l'air qui donne cette odeur désagréable puisqu'avant ça ne sentait rien.
Dans un second temps, parfois on voit des nuages dans le ciel et alors il se met à pleuvoir (ce qui n'arrive pas quand le ciel est bien bleu).
Les nuages pourraient ressembler à la fumée du feu donc c'est tentant de faire le rapprochement.
Et quand il y a du brouillard bas, on voit physiquement cette matière même si on peut passer à travers.
On sent l'humidité sur notre visage. Ça doit donc être encore de l'eau mais différente.
Il doit y avoir un autre état pour l'eau même s'il est moins visible que la glace ou l'eau liquide.
Et effectivement, un jour on laisse de l'eau dans un trou de pierre à côté du feu. L'eau chauffe, se met à faire des bulles puis de la fumée (qui pourrait ressembler à celle du feu, quoique plus transparente).
Au bout de quelques minutes, l'eau a complètement disparu dans l'air. Ce troisième état, on va l'appeler gaz.
Ça nous donne 3 états possibles pour un matériau selon la température. Par exemple, pour l'eau, glace → eau liquide → fumée/vapeur.
Après cette notion de température est floue, car un jour, on passe près d'un volcan, et il y a une éruption avec une coulée de lave.
On arrive pas à s'approcher tellement il fait chaud. On voit bien la lave qui coule comme une rivière et qui descend la montagne.
Certains arbres s'enflamment sans même être touchés par la lave, et pourtant elle est bien liquide et non "en fumée" comme pour l'eau.
C'est vraiment bizarre.
Puis elle s'arrête en bas de la vallée et quelques jours plus tard on se rend compte que ce qui reste est solide et ressemble à de la terre ou des rochers alors que c'est encore brûlant.
Donc tout matériau peut devenir liquide même la terre ?
Apparemment oui, donc on se met à chauffer tout et n'importe quoi.
Certaines choses sont solides à température ambiante, d'autres non.
Pareil, certaines choses nécessitent d'être chauffées très fortement avant de passer à l'état gazeux.
Donc, on en est à faire chauffer tout ce qui passe à notre portée, des liquides, des aliments mais aussi des pierres par effet de bord.
Un jour, on remarque sans doute que certaines pierres qui trainaient à côté du feu ont changé de texture.
Elles se sont mises en bloc qui semblent très lourds par rapport à leur taille et surtout incassables.
À force d'essais et de perfectionnement des techniques, on arrivera à le faire avec plein de pierres différentes.
Ça nous donnera les "métaux", le fer, l'argent, le cuivre, l'or etc. associés à l'Antiquité.
Comme on n'a que peu de moyens, on peut les classer par des propriétés visuelles et physiques qui leur semblent propres, comme:
À vrai dire, ça semblerait même séduisant de dire que les éléments qui constituent les métaux semblent purs voire élémentaires comme on les a extraits et "isolés" depuis la terre. Ils constituaient la terre et maintenant ils sont nettoyés et regroupés ensemble.
Mais, on s'aperçoit aussi qu'on peut les mélanger entre eux pour faire des alliages.
Et donc, à priori on n'a aucun moyen de savoir si un métal est pur ou s'il est constitué de plusieurs constituants.
Cependant, quand on chauffe un alliage, les différents éléments ont tendance à se séparer en couches qui semblent ne pas vouloir se mélanger avec les autres.
Si on ne prend qu'une certaine couche en prenant une marge pour éviter de prendre une partie "contaminée" par un autre métal, on retombe sur des éléments qui semblent purs.
Et si on part d'un alliage, et qu'on retombe sur quelque chose dont on avait identifié la température de fusion, la couleur, avec qui et quoi il réagit, on peut progressivement éliminer les alliages et on espère que le reste est bel et bien pur.
Désormais, on connait bien une bonne partie des métaux. Si on regarde comment ils parlaient de la régule d'antimoine en 1751, on peut voir quel genre de traitement ils essayaient (non, tu manges pas le métal, recrache, recrache) :
On sait faire des alcools, des vinaigres. On connait certaines substances qui viennent attaquer certains métaux (les futurs acides, bases), la plupart étant synthétisées ie. obtenues en broyant/dissolvant/chauffant divers composants entre eux. Si comme moi, vous avez du mal avec ce mot synthétiser, voici un exemple concret :
On a donc un tas de produits plus ou moins purs à mélanger entre eux. Mais pour l'heure, on n'a toujours aucune idée de ce qu'elles contiennent réellement. Ces substances ont donc des noms folkloriques comme huile de vitriol (acide sulfurique), eau forte (acide nitrique) etc.
On remarque que certains composants ont tendance à s'unir ensemble. Cela donne l'idée à Étienne-François Geoffroy de faire une table d'affinités des substances connues en 1718 :

On distingue entre autres:
- des acides: acide de sel marin (HCl / acide chlorhydrique), acide nitreux (HNO₃ / acide nitrique), acide vitriolique (H₂SO₄ / acide sulfurique)
- des sels (les futures bases): sel alcali fixe (minerai de potasse contenant du chlorure de potassium / KCl), sel alcali volatil (ammoniac / NH₃), sel (chlorure de sodium / NaCl)
- des métaux rangées dans la catégorie "substances métalliques": mercure (Hg), or (Au), argent (Ag), cuivre (Cu), fer (Fe), plomb (Pb), étain (Sn), zinc (Zn), régule d'antimoine (antimoine / Sb).
- des esprits: esprit du vinaigre (acide acétique / C₂H₄O₂), esprit de vin (éthanol = alcool éthylique / CH₃-CH₂-OH)
Une version plus lisible du tableau avec les noms usuels d'aujourd'hui :

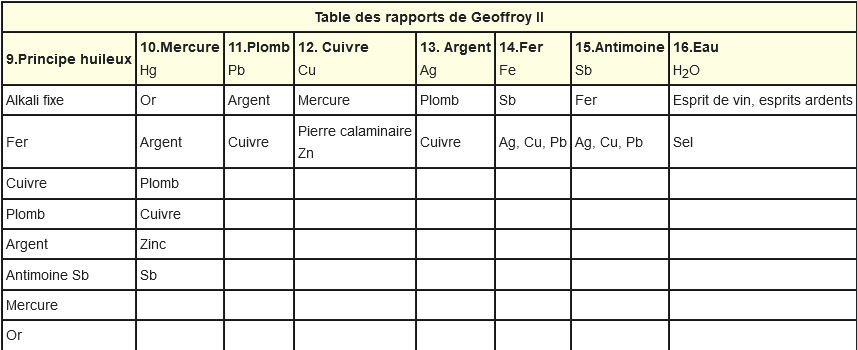
Avec nos connaissances actuelles, on voit que seuls les métaux sont purs au sens des futurs atomes. Le reste est constitué de composants qui sont les futures molécules.
Pareil, l’antimoine se trouve apparemment le plus facilement sous forme de sulfures, combiné, associé ou non avec d’autres métaux (plomb, cuivre, argent).
Comment va-t-on passer de cette vision à la vision moléculaire et atomique ?
Pour faire simple, en cassant progressivement des composés qu'on pense être des éléments à travers diverses expériences chimiques.
En particulier, l'état gazeux va aider.
On va finir par se demander si la digestion des animaux est le résultat de la mastication ou si une réaction chimique entre en jeu.
Cela va ouvrir la porte l'invention d'une cuve à eau et à l'étude des gaz qu'on appelle encore par des petits noms comme
Première étape notable, c'est donc sans doute Henry Cavendish qui va réussir à isoler le futur dihydrogène (en refaisant la réaction découverte par Boyle). Il pèse celui-ci à 10x moins que l'air normal (2*1 = 2 pour H₂ versus 80%*14*2 + 20%*16*2 ≈ 29 pour l'air, on est pas mal). Aussi en passant il montre que le futur CO₂ pèse moitié plus que l'air normal (12+16*2 = 44 ≈ 1.5*29) et que la présence de ce dernier dans l'atmosphère en quantité appréciable suffit pour empêcher les combustions et causer la mort.
Seconde étape, le chimiste Joseph Priestley découvre entre autre la photosynthèse. Il allume une bougie dans un espace clos (cloche de verre), et la bougie finit par s'éteindre. Lorsqu'une souris est introduite dans cet espace clos, elle décède rapidement. Lorsque que l'expérience est répétée avec une plante de menthe, il constate que la plante ne meurt pas avant plusieurs semaines. A l'issue de cette période, lorsqu'une souris vivante est introduite dans l'espace clos, elle ne meurt pas et une bougie allumée ne s'éteint pas immédiatement. Ce partie de l'air normal qui disparaît avec la flamme de bougie sera d'abord appelé air déphlogistiqué.
Lavoisier reprend les expériences de Priestley et va réussir à quantifier deux composants de l'air atmosphérique. Il se serait apparemment trompé (d'ailleurs le papier est super intéressant) car il trouve 16.6% d'air déphlogistiqué pour 83.3% d'un autre qu'il appelle mofette atmosphérique, mais pas de loin comme c'est plutôt 1/5 pour 4/5 (soit 20% et 80%).
Pour trouver ça, il chauffe sous cloche du mercure qui est un métal liquide à température ambiante. Progressivement, il voit des pastilles rouges (oxyde de mercure).
Le dioxygène de l'air de la cloche s'est fixé sur le mercure. Il ne reste donc que le futur diazote et les gaz rares de l'air.
Il remarque comme Priestley qu'un animal ne peut pas survivre si on le place dans la cloche. Ce n'est donc plus de l'air et l'air n'est pas un élément atomique.
Ce qui est bien pratique avec son expérience, c'est qu'il peu isoler deux gaz : le diazote et les gaz rares (première partie quand le O₂ se fixe sur le mercure) et le dioxygène (quand il chauffe l'oxyde de mercure ensuite).
À un moment, j'étais perdu dans les méandres de l'histoire car je pensais que c'était en 1800 que l'électrolyse avais permis de casser l'eau en deux et donc de faire du dihydrogène.
Mais en fait, on l'a vu, on savait déjà faire du dihydrogène depuis 1671 grâce à Boyle mais c'est sans doute Cavendish (qui est son contemporain) qui l'avait remis vraiment sur le devant de la scène, surtout en lui donnant un nom.
En 1783, il était donc en possession des 2 éléments qui permettent de faire de l'eau, et il pensait trouver un acide en les combinant.
Sauf qu'il a fabriquer de... l'eau. L'eau n'est pas un élément mais une molécule, et le gaz qui a permis de faire de l'eau, il l'appelle hydrogène (de « hydro », « eau », et « gène », « engendrer »)
Ensuite, toujours inspiré, il met de l'étain dans un vase clos, il mesure finement la masse air + étain, puis il calcine cet étain.
Après réaction, la masse "air final" + étain n'a pas changé.
Mais la masse étain avec sa couche calcinée a une masse plus importante et donc la masse de l'air a diminué.
À l'école, il me semble qu'on fait habituellement avec de la laine de fer qui se transforme en oxyde de fer (le PDF est super d'ailleurs, il y a plein d'expériences autour de ces trucs pas super intuitifs).

Pour peser finement, il a sans doute dû utiliser les dernières techniques voire améliorer les outils de pesées existants.
C'est le fameux "Rien ne se perd, rien ne se crée, tout se transforme" qu'on nous apprend à l'école.
Un peu plus tard, Joseph Louis Proust publie la loi des proportions définies.
Imaginons qu'on ait remarqué que deux composants se transforme en eau si on les mélange (les futurs hydrogène et oxygène) et qu'on ait ces deux composants dans des conteneurs isolés qu'on peut peser finement ce qui est maintenant possible (cf. plus haut avec Lavoisier), on va par exemple remarquer qu'il faut 1 masse du futur hydrogène pour 8 masses du futur dioxygène.
Avec le recul, la molécule H₂O contient bien 2 atomes de H (de masse 1) pour 1 atome de O (de masse 16)
Également, il regarde les oxydes d'étain qui peuvent se présenter sous deux formes différentes.
La réaction qui les forme est conditionnée par certaines masses bien définies d'étain et d'oxygène.
En mettant diverses quantités d'oxygène et d'étain ensemble, la réaction produit du dioxyde d'étain (SnO₂) qui est un solide incolore ou de l'oxyde d'étain(II) SnO qui est un solide noir bleuté. Autant, ça semble délicat de prédire quels oxydes sont présents en quelles quantité dans ce genre de réaction, autant on peut peut partir d'un oxyde d'étain connu et le chauffer doucement comme l'a fait Lavoisier. On va retrouver de l'étain pur débarrassé de son oxyde.
Il s'agit maintenant d'estimer la masse du gaz. Lavoisier a réussi à le faire avec des gazosphères donc ça devait pouvoir se faire aussi (ou en partant d'une enceinte sous vide d'air).
Sinon on fait la masse de l'étain oxydée de départ moins la masse d'étain pur après refroidissement.
Bon, je ne suis pas trop de la méthode mais disons que c'est sous contrôle.
Selon ses essais, il trouve donc des oxydes où il y avait :
John Dalton enfonce le clou juste après avec la loi des proportions multiples.
Il reprend les pourcentages de Proust ci-dessus et calcule qu'on va avoir besoin pour 100g d'étain, de 100/88.1*11.9 = 13.5g d'oxygène pour le futur oxyde d'étain et 100/78.7*21.3 = 27g d'oxygène pour le futur dioxyde d'étain. Ah... Il y a un joli rapport 1 pour 2 ici et ce sera toujours un entier dans les autres expériences qu'il pourra faire. C'est un peu trop beau pour être une coïncidence, et ce sera donc énoncé dans sa loi des proportions multiples.
Bon, ça y est ! On commence à voir arriver la théorie atomique. Dalton a remarqué que l'hydrogène semble toujours être le moins massif. Il le prend comme unité de base pour relativiser les autres (ie. m=1) et recommence avec d'autres substances jusqu'à avoir une table de masses atomiques relatives.
Le problème c'est qu'on avance un peu à l'aveugle. Comment distinguer les futures molécules des futurs atomes avec cette méthode ?
On ne peut pas savoir. Il va ainsi se planter sur l'oxygène O qui en fait du dioxygène O₂. Pareil pour l'eau, il la croit HO mais c'est H₂O.
Ce sera finalement Gay-Lussac et Alexander von Humboldt qui vont montrer que l'eau est formée de deux atomes d'hydrogène et d'un d'oxygène en 1805.
Pour cela, ils ont raisonné avec des volumes de gaz et non des masses.
Puis en 1811, Amedeo Avogadro corrige l'erreur de Dalton.
Le problème de raisonner en masse c'est que les masses ne peuvent pas nous indiquer la décomposition exacte par ce genre d'expérience.
Avogadro fait une hypothèse en partant du principe que les gaz parfaits à volume + température + pression constants contiennent le même nombre de particules. En d'autres termes si on prend dans les conditions ci-dessus, un litre de ce qu'on appelle gaz dioxygène maintenant et un litre d'hydrogène, ils contiendront tous les deux le même nombre de particules.
S'il faut donc 2 litres "d'hydrogène" + 1 litre "d'oxygène" pour faire 2 litres de vapeur d'eau, cela signifie que chaque particule est constituée d'une particule du gaz d'hydrogène et d'une demi-particule du gaz "oxygène". C'est pas forcément trivial comme déduction, et je trouve qu'on voit plutôt une preuve de la formule H₂O ici.
Donc, comment a-t-il fait pour en arriver à cette conclusion ? On a dit que le nombre de particules est fixe par litre.
Imaginons le plus petit des cas: qu'on ait 2 particules d'hydrogène et 1 particule d'oxygène qui nous donne 2 particules d'eau.
Pour faire 2 particules d'eau, on peut prendre les particules d'hydrogène telles quelles. Mais pour l'oxygène, on va devoir la casser en deux.
Cela prouve que le gaz qu'on appelait oxygène n'était pas atomique lui-même et qu'au minimum on pouvait le casser en deux ce qui fait de ce gaz une substance non élémentaire. Ça pourrait être quelque chose comme O₂ ou O₄ ou même X₂Y₄, mais pas O puisqu'il faut pouvoir le diviser en deux.
Ce serait finalement O₂ d'où le nom dioxygène quand on parle du gaz.
Après la combustion du dihydrogène dans le dioxygène de l'air pour donner de l'eau était piégeuse je trouve : ce n'est pas 2 H + 1/2 O₂ ⟶ H₂O ou 4 H + O₂ ⟶ 2 H₂O mais 2 H₂ + O₂ ⟶ 2 H₂O. Bref "l'hydrogène" était en fait du dihydrogène et donc il n'était pas pur non plus...
Néanmoins, ça reste compliqué d'avoir une distinction claire en composés (contenant potentiellement différentes molécules), molécules et briques "élémentaires" (atomes)
Parallèlement, Alessandro Volta invente la pile électrique. Voilà encore une idée brillante !
Une paire de disques de zinc et cuivre séparés par un tissu imbibé d'eau (électrolyte) constitue un générateur élémentaire qui fournit une tension de 0.76V environ.
Si on prend de l'eau salée, ça marche encore mieux ! C'est probablement la même chose qu'avec le fer qui rouille. Avec de l'eau ça rouille lentement.
Avec de l'eau salée, il faut mieux éviter d'oublier une clé dans sa poche quand on va se baigner dans la mer. Voilà le massacre en quelques heures seulement !
Volta a empilé ces disques qui ont donc cumulé la tension de chaque paire de disques (ça équivaut à mettre des générateurs de tension en série).
Il s'était planté sur le fond du fonctionnement car il croyait que la partie intéressante se passait au contact métal/métal entre les disques (alors que c'est au niveau de l'eau que ça se passe) et sur sa pile il y avait donc un disque de cuivre en haut et un disque de zinc en bas (pour rien).
Déjà, le cuivre ne sert à rien si ce n'est de pas réagir avec l'eau dans une réaction qui générerait des électrons (donc on pourrait sans doute prendre d'autres métaux).
La partie intéressante c'est le côté zinc + eau : le zinc se fait oxyder lors d'une réaction d'oxydation (Zn → Zn2+ + 2 e-) et il y a donc des électrons qui trainent en trop dans la partie zinc (par rapport à un état neutre).
Comme il n'y a pas de réaction similaire côté cuivre (qui lui est neutre), il y a une différence de potentiel entre les deux disques.
Si on ferme le circuit, les électrons se mettent à "couler" dans le circuit, passent dans le cuivre qui les laisse passer sans contrainte, puis viennent réagir avec l'eau pour former du dihydrogène (2 H2O + 2 e- → 2 HO- + H2). Pour que l'ensemble fonctionne, il faut que les électrons qui arrivent du cuivre soient évacués, sinon le potentiel s’équilibrerait et la tension électrique deviendrait nulle (arrêtant par la même occasion la circulation électrique ie. le courant).

Cette invention va permettre de mettre en place un nouveau procédé : l'électrolyse, qui va permettre de découvrir un grand nombre de nouveaux éléments.

En plus de faire découvrir des nouveaux éléments, la pile de Volta et l'électrolysent amène une question.
Comment "quelque chose" peut-il circuler dans un fil électrique ou dans l'eau sans mouvement apparent du fil lui même.
Si je ferme un circuit en joignant avec des doigts mouillés, deux fils qui vont aux bornes de la pile, ça fait mal mais sans raison apparente.
La seule manifestation physique, c'est que certains fils peuvent devenir rouges et chauffer si on les met entre les deux bornes.
Si les métaux sont bel et bien faits d'atomes, il doit donc y avoir quelque chose de plus petit qui permet cette circulation d'énergie.
Pour l'instant on est toujours plus ou moins englués dans qui est quoi...
Lavoisier avait proposer son tableau d'éléments en 1789 et c'était déjà pas mal !
Là vers 1820, on pousse le raisonnement en essayant de recréer des substances connus à partir de combinaison des éléments C (Carbone), H (hydrogène), O (oxygène), P (phosphore), N (azote).
C'est le début de la chimie organique.
Alors ici ça devient difficile de retracer les découvertes je trouve. Le meilleur lien qui permet d'essayer de suivre serait selon moi celui-ci.
On avait remarqué que l'hydrogène avait la masse la plus faible qu'on connaissait.
Au fur et à mesure des découvertes, on va remarquer dans les formules qu'il s'attache facilement à plein de choses (comme dans H₂O, CH₄).
On va progressivement en conclure que certains atomes peuvent s'attacher à 1, 2, 3 ou 4 atomes d'hydrogène.
Cela va progressivement faire émerger la notion de valence qui va être décisive dans le tableau périodique.
Aux alentours de 1816, Eugène Chevreul commence une étude des savons à partir de différents corps gras et alcalis.
Il sépare les différents acides (acides stéariques et oléiques, auxquels il donne leur nom) qui, en combinaison avec les alcali, produisaient le savon.
En 1834, Jean-Baptiste Dumas et Auguste Laurent montrent que les liaisons ne sont pas de types dipolaires.
On voit dans cet article que ce n'était pas encore bien facile d'y voir clair.

En particulier, ces travaux semblent ouvrir la possibilité de la tétravalence du carbone.

Malheureusement, la tétravalence du carbone ne semble pas marcher pas avec le composé benzène C₆H₆ découvert par Michael Faraday en 1825.
Si on raisonne simplement avec des liaisons simples, avec le benzène C₆H₆, on a 6 liaisons C-C, et il reste 2 liaisons à remplir par C.
Donc, on devrait avoir C₆H₁₂ au lieu de C₆H₆. En 1866, August Kekulé proposera la possibilité de double liaison (après avoir postulé que le carbone est toujours tétravalent), ce qui résout le problème du benzène évoqué ci dessus.
Si on raisonne avec des liaisons simples et double, avec le benzène C₆H₆, on peut avoir 3 liaisons C-C, 3 doubles liaisons C=C, et il reste 1 liaison à remplir par C.
Donc, on peut bien construire une molécule C₆H₆ dans ces conditions.

Néanmoins, cela met fin à la théorie de Berzélius, qui est alors remplacée par la théorie des types (= fonction chimique).
Vers 1850, Marcellin Berthelot reconstitue le méthane (CH₄), le méthanol (CH₃OH), l'éthyne (C₂H₂) et le benzène (C₆H₆) à partir de leurs éléments (H/C/O qu'on connait bien depuis au moins Lavoisier).
En 1852, Edward Frankland introduit une "capacité de saturation" qui est une certaine capacité d'échange avec les autre éléments et commence vraiment à introduire la valence.
En 1858, Kekulé propose que le carbone est tétravalent et toujours tétravalent (donc qu'il faut qu'il ait toujours 4 liaisons).
Pour lui, les composés organiques sont constitués par des enchaînements d'atomes de carbone, ayant échangés entre eux, une ou plusieurs unités de saturation.
En 1860, la confusion entre atome et molécule est toujours probablement aussi forte.
Pour Kekulé, "une molécule est un groupe d'atomes parfaitement identiques ne se décomposant que dans les réactions chimiques".
Alors là on commence à envoyer du lourd en termes de puissance d'analyse...
Toujours en 1860, l'optique vient en renfort de la chimie avec la spectroscopie.
L'étude des spectres lumineux permet d'identifier de nouveaux éléments jusqu'alors inconnus (césium, rubidium, thallium, iridium, lithium, gallium, samarium...)
Comment souvent, il y a plusieurs étapes au fil du temps qui commence probablement avec Newton qui découvre le spectre de la lumière à travers un prisme.
En 1752, Thomas Melvill chauffe des sels de sodium et regarde la lumière de la flamme à travers un prisme de verre, et voit une raie intense et jaune.


En 1802, William Hyde Wollaston signale que le spectre de la lumière du soleil est discontinu (avec des bandes noires) alors que d’habitude il est continu avec d'autres sources lumineuses.
Ces raies ne changent pas de position quel que soit le prisme utilisé. Ça semble donc être une signature.
En 1814, Joseph Von Fraunhofer regarde le spectre du soleil et des étoiles à travers d'un petit télescope et constate aussi la présence de ces raies noires. Il s'en sert pour proposer une manière de mesurer les longueurs d'onde en prenant ces raies comme référence.

En 1860, Robert Wilhelm Bunsen (qui invente le bec Bunsen au passage) et Gustav Kirchhoff étudient les eaux minérales qui contiennent probablement des sels minéraux.
Ils constatent que les raies spectrales sont caractéristiques des sels, cumulatives et sensibles, et prédisent qu'elle permettra de découvrir de nouveaux éléments.
Kirchhoff remarque que si une lumière blanche intense (qui devrait normalement donner un spectre continu) traverse la flamme de sodium et est analysée, on observe une raie noire là où on aurait eu un raie jaune si on avait chauffé du sodium et regarder directement la lumière du sodium chauffer (comme Melvill en 1752).
Cela lui permet d’interpréter les raies de Fraunhofer comme étant l'absorption de la lumière par les éléments que contiennent les corps célestes.
Un spectre lumineux nous renseigne sur la température de la matière chauffée qui émet cette lumière.
Plus c'est chaud, plus la lumière est blanche. Si la lumière a une couleur (par exemple, légèrement jaune pour le soleil) alors il manquera certaines longueurs d'onde (voir un peu plus haut dans le spoiler).
S'il y a des raies noires, il y a donc des gaz sur le trajet de la lumière qui créent ces bandes. On ne sait pas trop où à priori (notre atmosphère, autour du soleil, entre le soleil et nous) mais ça doit exister !
Ils comprennent rapidement l'importance de cette analyse, qui cascade de nouvelles découvertes juste après
En 1860, ils découvrent puis isolent le césium. En 1861, le rubidium.
En 1861, William Crookes découvre le thalium.
En 1863, Ferdinand Reich et Jeremias Benjamin Richter découvrent l'iridium.
En 1865, Bunsen isole le lithium.
En 1875, Paul Lecoq de Boisbaudran découvre le gallium puis le samarium (1879)
La nécessité de classer les éléments connus alors redevient pressante.
Plusieurs essaieront de proposer une classification pertinente mais c'est finalement Dmitri Mendeleïev qui va proposer la classification périodique des éléments qui va lentement converger vers celle que nous connaissons.
Mais pour en arriver là, les scientifiques vont bien tâtonner encore.
On a vu apparaître des essais de premières tables (Geoffroy en 1718, Lavoisier en 1789) mais le regroupement était surtout sur les propriétés et les affinités.
Désormais, on a plusieurs indicateurs qui nous permettent de parler de similitudes tangibles entre les éléments
Dès 1817, Johann Döbereiner essaie de regrouper les éléments par triades selon leurs propriétés et un constat mathématiques de demi-somme
En 1859, Jean-Baptiste Dumas ajoute un quatrième élément à la tétrade et abonne la moyenne arithmétique au profit d'une progression "similaire" d'une tétrade à l'autre.
Par exemple:

Donc on est en train de dire qu'à la louche, et si on regarde les poids atomiques, on passe
Ça peut sembler approximatif mais ça marche sur plus d’éléments que les triades. Et on voit arriver un nombre qui mesure une période entre des éléments.
Quand on commence à remarquer que chaque élément semble avoir un masse atomique unique, une première clé de tri semble donc s'imposer naturellement : leur masse atomique croissante.
En 1862, Alexandre-Émile Béguyer de Chancourtois classe les éléments chimiques alors connus en fonction de leur masse atomique déterminée en 1858 par le chimiste italien Stanislao Cannizzaro.
Il normalise par rapport à l'oxygène au lieu de l'hydrogène et crée un cylindre sur lequel on voit de plus en plus arriver la périodicité.
Il retrouve certaines triades et tétrades alignées (ex: O:16, S:32, Se:79, Te:128)

En 1866, John Alexander Newlands s'aperçoit, en classant les éléments par ordre croissant de poids atomiques, d'une répétition de propriétés tous les 7 éléments (loi des octaves)
Il les classe dans un tableau à sept lignes en les arrangeant de telle sorte que leurs propriétés chimiques soient similaires par lignes, sans hésiter à placer deux éléments dans une même case si nécessaire pour éviter de laisser des cases vides par ailleurs. Il avait apparemment pressenti que le tableau n'était pas complet, et par exemple prédit un nouvel élément, le futur germanium, dans une triade Si(28), ?(~70), Sn(118) mais n'avait pas prévu de place pour lui dans son tableau.
Et chose beaucoup plus gênante, il avait un problème de périodicité comme Chancourtois, car si les éléments légers connus à l'époque avaient bien une périodicité chimique tous les sept éléments, cela cessait d'être valable au-delà du calcium. En d'autres termes, les éléments

En 1860, William Odling propose une classification proche de celle publiée par Mendeleïev avec des cases vides là il n'y a pas d'éléments.

En 1864, Julius Lothar Meyer publie une première version du tableau périodique en 6 familles

En 1868, il propose un second tableau qui est une véritable classification périodique
À l'aide d'un première publication de Mendeleïev qu'il découvre la périodicité des éléments en traçant graphiquement le volume atomique, en fonction du poids atomique.
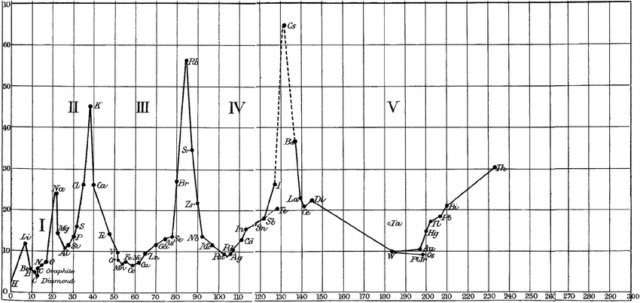

En 1871, Mendeleïev publie sa table avec 8 affirmations

C'est pas forcément évident de retrouver le tableau périodique actuel.
Mais quand même, quel tour de force d'arriver à faire ressortir les 6 premières périodes...
C'est pas très clair tout ça... J'avoue que je ne vois pas trop les étapes ici.

En attendant, essayons de retourner tout ça (en gros une rotation de 90° et une symétrie d'axe vertical) pour mieux comparer avec qu'on connait maintenant.


On voit que si on regarde juste la période (le numéro de ligne, donc le futur nombre de couches électroniques), il y a peu d'erreurs (en rouge).
Également il a mis des ? avec des masses attendues à certains endroits.
Comment a-t-il su ? Et pourquoi pas partout où il y avait des trous ?
Prenons les deux accolés qu'il a mis entre ses Zn(65.2) et As(75).
On a vu que plus haut que les tétrades prenaient un ordre de grandeur à la louche entre les périodes.
Si on se place juste avant et après on a respectivement 65.2-24 = 41.2 et 75-31 = 44.
Si on prend, aller 42, on a donc 27.1 + 42 ≈ 68 et 28 + 42 = 70 pour ces deux éléments hypothétiques.
Pareil pour le dernier à gauche de Ta, Ta - Nb = 88 donc 90 + 88 ≈ 180 pour ce dernier élément hypothétique.
Après il a eu raison de ne pas insister de trop car entre Hg et Au par exemple, il y avait des incertitudes de précision.
Ils sont en fait accolés dans la table qu'on connait actuellement.
En plus d'avoir prédit leur masse atomique, il a réussi aussi à prédire leur densité et d'autres caractéristiques
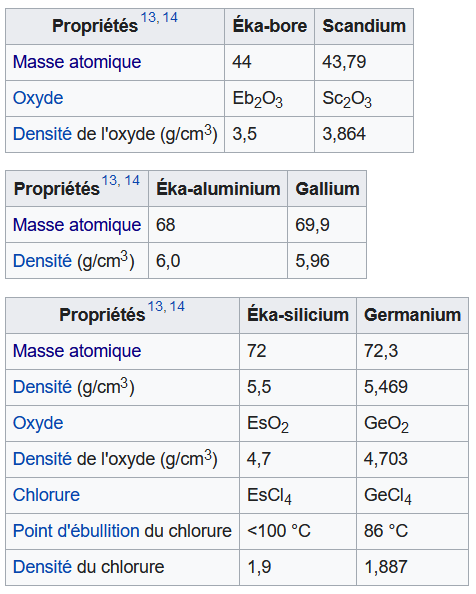
Vers 1900, on a apparemment identifié les éléments suivants

Aide bienvenue car c'est pas forcément facile de résumer et d'identifier les différentes petites marches qui ont mené à notre vision de l’infiniment petit
EDIT 20210512: Amélioration partie chimie
EDIT 20210522: Amélioration partie chimie avec Cavendish + isolation dihydrogène utilisé par Lavoisier + électrolyse
EDIT 20210523: Spectroscopie + tableau périodique
EDIT 20210529: Calcul volume atomique Meyer + erreur dans le spoiler sur la périodicité
Découverte des 3 états
Partons d'une situation où on ne connait rien de ce qu'on connait aujourd'hui. Pas de molécules, pas d'atomes, rien.
À notre niveau, on voit assez facilement que certaines choses semblent liquides (eau) et d'autres solides (terre).
Chose intrigante, si on habite prêt d'un cours d'eau qui gèle en hiver, on voit que l'eau peut devenir solide parfois puis refondre au printemps selon la température.
On ne sait pas trop ce qu'une élévation de la température engendre mais les deux états semblent liés à la température.
On en arrive au postulat que ce qui est froid a tendance à être solide, et à une certaine température ça devient liquide.
Ça nous donne 2 états possibles pour un matériau. Par exemple, pour l'eau, glace → eau liquide.
Une autre chose intrigante, c'est l'air dans lequel nous évoluons. On pourrait croire qu'il n'y a rien mais on ne peut s'empêcher de respirer.
On ne voit rien qui rentre dans notre corps, mais nos poumons doivent forcément utiliser quelque chose dans cet "air".
De même, si on souffle sur sa main, on sent un filet qui rappelle l'eau si on met sa main dans le courant d'une rivière.
Puis, un jour, la foudre s'abat sur un arbre et il prend feu. On voit de la fumée qui semble s'élever dans le ciel.
Après plusieurs heures, le feu s'éteint et il reste seulement une sorte de poudre au niveau de l'arbre. La matière semble avoir disparu en grande partie ainsi que le feu et la fumée.
Pourtant, ça ne sent pas bon... Il y a une odeur acre partout et très loin autour du feu, comme si ce qui donne l'odeur s'était "étalé" partout.
Il semble donc y avoir une substance nouvelle dans l'air qui donne cette odeur désagréable puisqu'avant ça ne sentait rien.
Dans un second temps, parfois on voit des nuages dans le ciel et alors il se met à pleuvoir (ce qui n'arrive pas quand le ciel est bien bleu).
Les nuages pourraient ressembler à la fumée du feu donc c'est tentant de faire le rapprochement.
Et quand il y a du brouillard bas, on voit physiquement cette matière même si on peut passer à travers.
On sent l'humidité sur notre visage. Ça doit donc être encore de l'eau mais différente.
Il doit y avoir un autre état pour l'eau même s'il est moins visible que la glace ou l'eau liquide.
Et effectivement, un jour on laisse de l'eau dans un trou de pierre à côté du feu. L'eau chauffe, se met à faire des bulles puis de la fumée (qui pourrait ressembler à celle du feu, quoique plus transparente).
Au bout de quelques minutes, l'eau a complètement disparu dans l'air. Ce troisième état, on va l'appeler gaz.
Ça nous donne 3 états possibles pour un matériau selon la température. Par exemple, pour l'eau, glace → eau liquide → fumée/vapeur.
Après cette notion de température est floue, car un jour, on passe près d'un volcan, et il y a une éruption avec une coulée de lave.
On arrive pas à s'approcher tellement il fait chaud. On voit bien la lave qui coule comme une rivière et qui descend la montagne.
Certains arbres s'enflamment sans même être touchés par la lave, et pourtant elle est bien liquide et non "en fumée" comme pour l'eau.
C'est vraiment bizarre.
Puis elle s'arrête en bas de la vallée et quelques jours plus tard on se rend compte que ce qui reste est solide et ressemble à de la terre ou des rochers alors que c'est encore brûlant.
Donc tout matériau peut devenir liquide même la terre ?
Apparemment oui, donc on se met à chauffer tout et n'importe quoi.
Certaines choses sont solides à température ambiante, d'autres non.
Pareil, certaines choses nécessitent d'être chauffées très fortement avant de passer à l'état gazeux.
- Légère digression temporelle (point critique/point triple):
Découverte des métaux
Donc, on en est à faire chauffer tout ce qui passe à notre portée, des liquides, des aliments mais aussi des pierres par effet de bord.
Un jour, on remarque sans doute que certaines pierres qui trainaient à côté du feu ont changé de texture.
Elles se sont mises en bloc qui semblent très lourds par rapport à leur taille et surtout incassables.
- Réduction du minerai de fer:
À force d'essais et de perfectionnement des techniques, on arrivera à le faire avec plein de pierres différentes.
Ça nous donnera les "métaux", le fer, l'argent, le cuivre, l'or etc. associés à l'Antiquité.
Comme on n'a que peu de moyens, on peut les classer par des propriétés visuelles et physiques qui leur semblent propres, comme:
- Dureté: certains sont malléables et si on met un coup de marteau dessus, on crée une marque, d'autres extrêmement durs et le marteau rebondit sans rien laisser.
- Apparence: chacun a sa couleur, certains sont dorés, d'autres gris, d'autres un peu marrons etc.
- Stabilité: certains réagissent avec l'air ou l'eau et changent de couleur avec le temps (marron pour le fer, vert pour le cuivre, etc.)
- Température de fusion: certains fondent à une température, d'autres à une température complètement différente.
À vrai dire, ça semblerait même séduisant de dire que les éléments qui constituent les métaux semblent purs voire élémentaires comme on les a extraits et "isolés" depuis la terre. Ils constituaient la terre et maintenant ils sont nettoyés et regroupés ensemble.
Mais, on s'aperçoit aussi qu'on peut les mélanger entre eux pour faire des alliages.
Et donc, à priori on n'a aucun moyen de savoir si un métal est pur ou s'il est constitué de plusieurs constituants.
Cependant, quand on chauffe un alliage, les différents éléments ont tendance à se séparer en couches qui semblent ne pas vouloir se mélanger avec les autres.
Si on ne prend qu'une certaine couche en prenant une marge pour éviter de prendre une partie "contaminée" par un autre métal, on retombe sur des éléments qui semblent purs.
Et si on part d'un alliage, et qu'on retombe sur quelque chose dont on avait identifié la température de fusion, la couleur, avec qui et quoi il réagit, on peut progressivement éliminer les alliages et on espère que le reste est bel et bien pur.
Chimie/proportions/molécules
Désormais, on connait bien une bonne partie des métaux. Si on regarde comment ils parlaient de la régule d'antimoine en 1751, on peut voir quel genre de traitement ils essayaient (non, tu manges pas le métal, recrache, recrache) :
Les avancées ont aussi permis de développer certaines techniques comme la distillation.https://fr.wikisource.org/wiki/L%E2%80%99Encyclop%C3%A9die/1re_%C3%A9dition/REGULE_d%E2%80%99antimoine a écrit:L’antimoine est un demi-métal d’une couleur blanche qui approche de celle de l’argent ; à l’intérieur il est composé d’un assemblage d’aiguilles ou de stries. Il n’a ni ductilité ni malléabilité, mais il se casse sous le marteau, & se réduit facilement en poudre. L’action du feu le dissipe & le volatilise ; il a aussi la propriété de volatiliser & d’entraîner avec lui tous les métaux, à l’exception de l’or & de la platine. A un feu doux il se calcine, & se réduit en une chaux ou poudre grise, qui est difficile à fondre, mais qui à un grand feu se convertit en un verre d’un jaune rougeâtre. L’antimoine se dissout dans l’acide du sel marin & dans l’eau régale ; l’acide nitreux ne fait que le rougir sans le dissoudre, & s’amalgame avec le mercure. Il a une très-grande disposition à s’unir avec le soufre, avec qui il constitue ce qu’on appelle l’antimoine crud. Ce demi-métal se distingue sur-tout par la propriété qu’il a d’exciter le vomissement lorsqu’on le prend intérieurement.
On sait faire des alcools, des vinaigres. On connait certaines substances qui viennent attaquer certains métaux (les futurs acides, bases), la plupart étant synthétisées ie. obtenues en broyant/dissolvant/chauffant divers composants entre eux. Si comme moi, vous avez du mal avec ce mot synthétiser, voici un exemple concret :
L’acide nitrique aurait été synthétisé pour la première fois [...] en chauffant du salpêtre KNO3 en présence de sulfate de cuivre CuSO4⋅5H2O et d’alun KAl(SO4)2⋅12H2O
https://fr.wikipedia.org/wiki/Histoire_de_la_chimie#Les_acides_et_les_bases a écrit:Certains acides commencent à être extraits du vivant ; ils sont, pour la plupart, issus des travaux de Scheele à partir de 1760. Citons, dans l’ordre chronologique, l’acide tartrique à partir du tartre (1769), l’acide urique à partir des calculs urinaires (1776), l’acide lactique à partir du lait (1780), l’acide citrique à partir du citron (1784), l’acide malique à partir des pommes (1785), l’acide gallique à partir des noix de galle (1786), l'acide oxalique à partir du sucre et de l’eau forte (1784). Il en est de même de l’acide fluorhydrique à partir d’huile de vitriol et de fluorine et de l’acide prussique obtenu par l’action de l’acide sulfurique sur un colorant, le bleu de Prusse.
En ce qui concerne les bases, nous savons que Lavoisier utilisait la potasse (ou alcali végétal) et la soude (alcali marin) qui avaient déjà été distingués par Duhamel du Monceau. Ce dernier, avec son collaborateur Jean Grosse, obtiennent la « liqueur de Frobenius » par action de l’huile de vitriol (acide sulfurique) sur l’esprit de vin (alcool éthylique). Jean Grosse met au point la technique de distillation de l’alcool en milieu sulfurique et précise les conditions d’obtention d’un produit pratiquement pur. L'ammoniac (alcali volatil) et le natron étaient également connus.
On a donc un tas de produits plus ou moins purs à mélanger entre eux. Mais pour l'heure, on n'a toujours aucune idée de ce qu'elles contiennent réellement. Ces substances ont donc des noms folkloriques comme huile de vitriol (acide sulfurique), eau forte (acide nitrique) etc.
On remarque que certains composants ont tendance à s'unir ensemble. Cela donne l'idée à Étienne-François Geoffroy de faire une table d'affinités des substances connues en 1718 :

On distingue entre autres:
- des acides: acide de sel marin (HCl / acide chlorhydrique), acide nitreux (HNO₃ / acide nitrique), acide vitriolique (H₂SO₄ / acide sulfurique)
- des sels (les futures bases): sel alcali fixe (minerai de potasse contenant du chlorure de potassium / KCl), sel alcali volatil (ammoniac / NH₃), sel (chlorure de sodium / NaCl)
- des métaux rangées dans la catégorie "substances métalliques": mercure (Hg), or (Au), argent (Ag), cuivre (Cu), fer (Fe), plomb (Pb), étain (Sn), zinc (Zn), régule d'antimoine (antimoine / Sb).
- des esprits: esprit du vinaigre (acide acétique / C₂H₄O₂), esprit de vin (éthanol = alcool éthylique / CH₃-CH₂-OH)
Une version plus lisible du tableau avec les noms usuels d'aujourd'hui :


Avec nos connaissances actuelles, on voit que seuls les métaux sont purs au sens des futurs atomes. Le reste est constitué de composants qui sont les futures molécules.
Pareil, l’antimoine se trouve apparemment le plus facilement sous forme de sulfures, combiné, associé ou non avec d’autres métaux (plomb, cuivre, argent).
Comment va-t-on passer de cette vision à la vision moléculaire et atomique ?
Pour faire simple, en cassant progressivement des composés qu'on pense être des éléments à travers diverses expériences chimiques.
En particulier, l'état gazeux va aider.
On va finir par se demander si la digestion des animaux est le résultat de la mastication ou si une réaction chimique entre en jeu.
Cela va ouvrir la porte l'invention d'une cuve à eau et à l'étude des gaz qu'on appelle encore par des petits noms comme
- l’air normal ou atmosphérique,
- l’air des métaux (ou air inflammable car il entretient la combustion, le futur dihydrogène H₂)https://fr.wikipedia.org/wiki/Hydrog%C3%A8ne a écrit:L'hydrogène se trouve aussi dans les émanations de certains volcans sous forme H₂ et de méthane CH₄.
Ce gaz a été mis en évidence par Cavendish en 1766, qui l'a appelé « air inflammable » parce qu'il brûle ou explose en présence de l'oxygène, où il forme de la vapeur d'eau.
[En 1671, Robert Boyle avait décrit la réaction entre le fer et des acides dilués, qui donne ce fameux gaz, non identifié à l'époque] - l’air fixe (qui, au contraire, arrête la combustion, le futur dioxyde de carbone CO₂)https://fr.wikipedia.org/wiki/Dioxyde_de_carbone a écrit: Joseph Black découvrit qu'en chauffant ou en versant un acide sur du calcaire (roche composée de carbonate de calcium) [comme le marbre ou la craie], il en résultait l'émission d'un gaz, qu'il nomma « air fixe »
Première étape notable, c'est donc sans doute Henry Cavendish qui va réussir à isoler le futur dihydrogène (en refaisant la réaction découverte par Boyle). Il pèse celui-ci à 10x moins que l'air normal (2*1 = 2 pour H₂ versus 80%*14*2 + 20%*16*2 ≈ 29 pour l'air, on est pas mal). Aussi en passant il montre que le futur CO₂ pèse moitié plus que l'air normal (12+16*2 = 44 ≈ 1.5*29) et que la présence de ce dernier dans l'atmosphère en quantité appréciable suffit pour empêcher les combustions et causer la mort.
Seconde étape, le chimiste Joseph Priestley découvre entre autre la photosynthèse. Il allume une bougie dans un espace clos (cloche de verre), et la bougie finit par s'éteindre. Lorsqu'une souris est introduite dans cet espace clos, elle décède rapidement. Lorsque que l'expérience est répétée avec une plante de menthe, il constate que la plante ne meurt pas avant plusieurs semaines. A l'issue de cette période, lorsqu'une souris vivante est introduite dans l'espace clos, elle ne meurt pas et une bougie allumée ne s'éteint pas immédiatement. Ce partie de l'air normal qui disparaît avec la flamme de bougie sera d'abord appelé air déphlogistiqué.
Lavoisier reprend les expériences de Priestley et va réussir à quantifier deux composants de l'air atmosphérique. Il se serait apparemment trompé (d'ailleurs le papier est super intéressant) car il trouve 16.6% d'air déphlogistiqué pour 83.3% d'un autre qu'il appelle mofette atmosphérique, mais pas de loin comme c'est plutôt 1/5 pour 4/5 (soit 20% et 80%).
Pour trouver ça, il chauffe sous cloche du mercure qui est un métal liquide à température ambiante. Progressivement, il voit des pastilles rouges (oxyde de mercure).
Le dioxygène de l'air de la cloche s'est fixé sur le mercure. Il ne reste donc que le futur diazote et les gaz rares de l'air.
Il remarque comme Priestley qu'un animal ne peut pas survivre si on le place dans la cloche. Ce n'est donc plus de l'air et l'air n'est pas un élément atomique.
Ce qui est bien pratique avec son expérience, c'est qu'il peu isoler deux gaz : le diazote et les gaz rares (première partie quand le O₂ se fixe sur le mercure) et le dioxygène (quand il chauffe l'oxyde de mercure ensuite).
À un moment, j'étais perdu dans les méandres de l'histoire car je pensais que c'était en 1800 que l'électrolyse avais permis de casser l'eau en deux et donc de faire du dihydrogène.
Mais en fait, on l'a vu, on savait déjà faire du dihydrogène depuis 1671 grâce à Boyle mais c'est sans doute Cavendish (qui est son contemporain) qui l'avait remis vraiment sur le devant de la scène, surtout en lui donnant un nom.
En 1783, il était donc en possession des 2 éléments qui permettent de faire de l'eau, et il pensait trouver un acide en les combinant.
Sauf qu'il a fabriquer de... l'eau. L'eau n'est pas un élément mais une molécule, et le gaz qui a permis de faire de l'eau, il l'appelle hydrogène (de « hydro », « eau », et « gène », « engendrer »)
Ensuite, toujours inspiré, il met de l'étain dans un vase clos, il mesure finement la masse air + étain, puis il calcine cet étain.
Après réaction, la masse "air final" + étain n'a pas changé.
Mais la masse étain avec sa couche calcinée a une masse plus importante et donc la masse de l'air a diminué.
À l'école, il me semble qu'on fait habituellement avec de la laine de fer qui se transforme en oxyde de fer (le PDF est super d'ailleurs, il y a plein d'expériences autour de ces trucs pas super intuitifs).

Pour peser finement, il a sans doute dû utiliser les dernières techniques voire améliorer les outils de pesées existants.
Il en déduit que la masse totale d'une réaction chimique reste constante (en d'autres termes, les réactifs ont la même masse que les produits).http://www.lavoisier.cnrs.fr/ice/ice_page_detail.php?lang=fr&type=text&bdd=lavosier&table=Lavoisier&bookId=8&typeofbookDes=Memoires&pageOrder=2&facsimile=off&search=no a écrit: Il a calciné de l’étain dans des cornues fermées hermétiquement, après avoir pesé avec exactitude l’étain et la cornue ; il a vu qu’au bout d’un certain temps la calcination s’arrêtait, et qu’en continuant le feu il ne pouvait plus parvenir à calciner aucune partie d’étain ; alors il a cessé son opération, et, pesant ensuite la cornue avant de la rouvrir, il a trouvé que le poids total n’avait pas changé ; ouvrant enfin sa cornue, il a pesé l’étain, qu’il a trouvé augmenté de quelques grains, la cornue, pesée à part, avait le même poids qu’avant l’opération : l’augmentation réelle du poids de l’étain s’était donc faite absolument aux dépens de l’air renfermé dans la cornue, puisque le poids total, ainsi que le poids de la cornue, n’avait point changé.
C'est le fameux "Rien ne se perd, rien ne se crée, tout se transforme" qu'on nous apprend à l'école.
Un peu plus tard, Joseph Louis Proust publie la loi des proportions définies.
Imaginons qu'on ait remarqué que deux composants se transforme en eau si on les mélange (les futurs hydrogène et oxygène) et qu'on ait ces deux composants dans des conteneurs isolés qu'on peut peser finement ce qui est maintenant possible (cf. plus haut avec Lavoisier), on va par exemple remarquer qu'il faut 1 masse du futur hydrogène pour 8 masses du futur dioxygène.
Avec le recul, la molécule H₂O contient bien 2 atomes de H (de masse 1) pour 1 atome de O (de masse 16)
Également, il regarde les oxydes d'étain qui peuvent se présenter sous deux formes différentes.
La réaction qui les forme est conditionnée par certaines masses bien définies d'étain et d'oxygène.
En mettant diverses quantités d'oxygène et d'étain ensemble, la réaction produit du dioxyde d'étain (SnO₂) qui est un solide incolore ou de l'oxyde d'étain(II) SnO qui est un solide noir bleuté. Autant, ça semble délicat de prédire quels oxydes sont présents en quelles quantité dans ce genre de réaction, autant on peut peut partir d'un oxyde d'étain connu et le chauffer doucement comme l'a fait Lavoisier. On va retrouver de l'étain pur débarrassé de son oxyde.
Il s'agit maintenant d'estimer la masse du gaz. Lavoisier a réussi à le faire avec des gazosphères donc ça devait pouvoir se faire aussi (ou en partant d'une enceinte sous vide d'air).
Sinon on fait la masse de l'étain oxydée de départ moins la masse d'étain pur après refroidissement.
Bon, je ne suis pas trop de la méthode mais disons que c'est sous contrôle.
Selon ses essais, il trouve donc des oxydes où il y avait :
- Soit 88.1% d'étain pour 11.9% d'oxygène (en masse)
- Soit 78.7% d'étain pour 21.3% d'oxygène (en masse)
John Dalton enfonce le clou juste après avec la loi des proportions multiples.
Il reprend les pourcentages de Proust ci-dessus et calcule qu'on va avoir besoin pour 100g d'étain, de 100/88.1*11.9 = 13.5g d'oxygène pour le futur oxyde d'étain et 100/78.7*21.3 = 27g d'oxygène pour le futur dioxyde d'étain. Ah... Il y a un joli rapport 1 pour 2 ici et ce sera toujours un entier dans les autres expériences qu'il pourra faire. C'est un peu trop beau pour être une coïncidence, et ce sera donc énoncé dans sa loi des proportions multiples.
Modèle atomique de Dalton
Bon, ça y est ! On commence à voir arriver la théorie atomique. Dalton a remarqué que l'hydrogène semble toujours être le moins massif. Il le prend comme unité de base pour relativiser les autres (ie. m=1) et recommence avec d'autres substances jusqu'à avoir une table de masses atomiques relatives.
Cela permet de proposer le mondèle atomique de Daltonhttps://fr.wikipedia.org/wiki/Masse_atomique#Les_diff%C3%A9rentes_r%C3%A9f%C3%A9rences_de_masse_atomique_au_cours_de_l'histoire a écrit:1805 : John Dalton fixe la masse atomique de l'hydrogène à 1.
Quand la notion de masse atomique apparut, les premières mesures suggéraient que la masse atomique d'un atome était toujours un multiple entier de celle de l'hydrogène. Le choix de l'hydrogène comme masse atomique unitaire relevait donc plus d'un constat que d'un choix normatif.
Le problème c'est qu'on avance un peu à l'aveugle. Comment distinguer les futures molécules des futurs atomes avec cette méthode ?
On ne peut pas savoir. Il va ainsi se planter sur l'oxygène O qui en fait du dioxygène O₂. Pareil pour l'eau, il la croit HO mais c'est H₂O.
Ce sera finalement Gay-Lussac et Alexander von Humboldt qui vont montrer que l'eau est formée de deux atomes d'hydrogène et d'un d'oxygène en 1805.
Pour cela, ils ont raisonné avec des volumes de gaz et non des masses.
Puis en 1811, Amedeo Avogadro corrige l'erreur de Dalton.
Le problème de raisonner en masse c'est que les masses ne peuvent pas nous indiquer la décomposition exacte par ce genre d'expérience.
Avogadro fait une hypothèse en partant du principe que les gaz parfaits à volume + température + pression constants contiennent le même nombre de particules. En d'autres termes si on prend dans les conditions ci-dessus, un litre de ce qu'on appelle gaz dioxygène maintenant et un litre d'hydrogène, ils contiendront tous les deux le même nombre de particules.
S'il faut donc 2 litres "d'hydrogène" + 1 litre "d'oxygène" pour faire 2 litres de vapeur d'eau, cela signifie que chaque particule est constituée d'une particule du gaz d'hydrogène et d'une demi-particule du gaz "oxygène". C'est pas forcément trivial comme déduction, et je trouve qu'on voit plutôt une preuve de la formule H₂O ici.
Donc, comment a-t-il fait pour en arriver à cette conclusion ? On a dit que le nombre de particules est fixe par litre.
Imaginons le plus petit des cas: qu'on ait 2 particules d'hydrogène et 1 particule d'oxygène qui nous donne 2 particules d'eau.
Pour faire 2 particules d'eau, on peut prendre les particules d'hydrogène telles quelles. Mais pour l'oxygène, on va devoir la casser en deux.
Cela prouve que le gaz qu'on appelait oxygène n'était pas atomique lui-même et qu'au minimum on pouvait le casser en deux ce qui fait de ce gaz une substance non élémentaire. Ça pourrait être quelque chose comme O₂ ou O₄ ou même X₂Y₄, mais pas O puisqu'il faut pouvoir le diviser en deux.
Ce serait finalement O₂ d'où le nom dioxygène quand on parle du gaz.
- Comment ont-ils écarté les autres cas (plus tard) ?:
- Apparemment, en regardant plusieurs réactions faisant intervenir l'oxygène, certains vont remarquer qu'il y a toujours un x2 dans les molécules.http://scphysiques.free.fr/2nde/documents/histoire-atome2.pdf a écrit:En admettant, comme Berzelius, que l'eau renferme deux atomes d'hydrogène pour un atome d'oxygène et l'acide carbonique un atome de carbone pour deux d'oxygène, Gerhardt remarque que les quantités obtenues, dans les réactions de la chimie organique, correspondent toujours au double de ces formules : H₄O₂ au lieu de H₂O et C₂O₄ au lieu de CO₂. Il en déduit que les formules admises en chimie organique sont deux fois trop fortes et que cela complique inutilement l'écriture. Il propose donc de doubler les poids atomiques du carbone (12 au lieu de 6), de l'oxygène (16 au lieu de
 et de réduire de moitié les poids atomiques de certains métaux.
et de réduire de moitié les poids atomiques de certains métaux.
Après la combustion du dihydrogène dans le dioxygène de l'air pour donner de l'eau était piégeuse je trouve : ce n'est pas 2 H + 1/2 O₂ ⟶ H₂O ou 4 H + O₂ ⟶ 2 H₂O mais 2 H₂ + O₂ ⟶ 2 H₂O. Bref "l'hydrogène" était en fait du dihydrogène et donc il n'était pas pur non plus...
Néanmoins, ça reste compliqué d'avoir une distinction claire en composés (contenant potentiellement différentes molécules), molécules et briques "élémentaires" (atomes)
https://www.universalis.fr/encyclopedie/chimie-histoire/5-la-determination-des-masses-atomiques/ a écrit:Cependant, l'évaluation des masses atomiques rencontrait maintes difficultés : la théorie atomique n'était pas fermement établie et la distinction entre molécules et atomes ne devait s'imposer que tardivement ; on avait donc souvent peine à dénombrer les atomes présents dans une combinaison. Les chimistes durent alors combiner plus ou moins intuitivement et avec plus ou moins de bonheur les indices fournis par les considérations d'analogies structurales (familles naturelles de composés, théorie de l'isomorphisme de Mitscherlich) avec des grandeurs physiques. Parmi celles-ci, la mesure des densités gazeuses compte particulièrement ; son utilité apparaît clairement si l'on adopte l'hypothèse d'Avogadro : dans des conditions déterminées de température et de pression, le poids d'un volume donné de gaz ne dépend que de la masse des molécules ; car, si les molécules d'un gaz sont n fois plus lourdes que celles d'un autre, leur nombre étant supposé le même dans des volumes égaux, le même rapport doit apparaître dans la masse de ces volumes.
Parallèlement, Alessandro Volta invente la pile électrique. Voilà encore une idée brillante !
Une paire de disques de zinc et cuivre séparés par un tissu imbibé d'eau (électrolyte) constitue un générateur élémentaire qui fournit une tension de 0.76V environ.
Si on prend de l'eau salée, ça marche encore mieux ! C'est probablement la même chose qu'avec le fer qui rouille. Avec de l'eau ça rouille lentement.
Avec de l'eau salée, il faut mieux éviter d'oublier une clé dans sa poche quand on va se baigner dans la mer. Voilà le massacre en quelques heures seulement !
- Oxydation ou non du fer par l'eau (normale/salée/sans O₂):
Volta a empilé ces disques qui ont donc cumulé la tension de chaque paire de disques (ça équivaut à mettre des générateurs de tension en série).
Il s'était planté sur le fond du fonctionnement car il croyait que la partie intéressante se passait au contact métal/métal entre les disques (alors que c'est au niveau de l'eau que ça se passe) et sur sa pile il y avait donc un disque de cuivre en haut et un disque de zinc en bas (pour rien).
Déjà, le cuivre ne sert à rien si ce n'est de pas réagir avec l'eau dans une réaction qui générerait des électrons (donc on pourrait sans doute prendre d'autres métaux).
La partie intéressante c'est le côté zinc + eau : le zinc se fait oxyder lors d'une réaction d'oxydation (Zn → Zn2+ + 2 e-) et il y a donc des électrons qui trainent en trop dans la partie zinc (par rapport à un état neutre).
Comme il n'y a pas de réaction similaire côté cuivre (qui lui est neutre), il y a une différence de potentiel entre les deux disques.
Si on ferme le circuit, les électrons se mettent à "couler" dans le circuit, passent dans le cuivre qui les laisse passer sans contrainte, puis viennent réagir avec l'eau pour former du dihydrogène (2 H2O + 2 e- → 2 HO- + H2). Pour que l'ensemble fonctionne, il faut que les électrons qui arrivent du cuivre soient évacués, sinon le potentiel s’équilibrerait et la tension électrique deviendrait nulle (arrêtant par la même occasion la circulation électrique ie. le courant).

Cette invention va permettre de mettre en place un nouveau procédé : l'électrolyse, qui va permettre de découvrir un grand nombre de nouveaux éléments.
En 1800 (quelques semaines après l'invention de la pile de Volta), William Nicholson et Anthony Carlisle ont l'idée de brancher une pile de Volts sur un bol d'eau. Ils remarquent des bulles qui se forment aux deux bornes plongées dans l'eau. C'est l'électrolyse de l'eau ie. la séparation des deux parties de l'eau. En améliorant le procédé, ils arrivent à récupérer ces deux composants :https://en.wikipedia.org/wiki/Voltaic_pile a écrit:La pile voltaïque a ensuite permis une série rapide d'autres découvertes dont la décomposition électrique (électrolyse) de l'eau en oxygène et hydrogène par William Nicholson et Anthony Carlisle (1800) et la découverte ou l'isolement des éléments chimiques sodium (1807), potassium (1807), calcium (1808), bore (1808), baryum (1808), strontium (1808) et magnésium (1808) par Humphry Davy.

En plus de faire découvrir des nouveaux éléments, la pile de Volta et l'électrolysent amène une question.
Comment "quelque chose" peut-il circuler dans un fil électrique ou dans l'eau sans mouvement apparent du fil lui même.
Si je ferme un circuit en joignant avec des doigts mouillés, deux fils qui vont aux bornes de la pile, ça fait mal mais sans raison apparente.
La seule manifestation physique, c'est que certains fils peuvent devenir rouges et chauffer si on les met entre les deux bornes.
Si les métaux sont bel et bien faits d'atomes, il doit donc y avoir quelque chose de plus petit qui permet cette circulation d'énergie.
Mais on n'en est pas encore là. Ce sera plus tard qu'on va vraiment se pencher de nouveau sur cette question électrique.http://scphysiques.free.fr/2nde/documents/histoire-atome2.pdf a écrit:[En 1800,] Carlisle et W. Nicholson mettent au point le procédé d'électrolyse et réussissent à décomposer l'eau en ses deux éléments : l'oxygène se dégage au pôle positif et l'hydrogène au pôle négatif. C'est une formidable avancée pour l'analyse chimique : la séparation en deux parties du composé chimique par simple passage d'un courant électrique au sein de la solution.
En 1807, H. Davy utilise ce procédé pour décomposer les alcalis fixes, la potasse et la soude, qui avaient jusque-là résisté à l'analyse et que Lavoisier avait classés dans les corps simples pour rester cohérent à sa définition du corps simple, mais qu'il soupçonnait néanmoins être constitués d'oxygène et d'un radical inconnu.
H. Davy réussit à obtenir, par décomposition électrolytique de la potasse et de la soude, les deux nouveaux éléments métalliques que sont le potassium et le sodium.
La question qui se pose alors aux chimistes est la suivante : si la matière est bien composée d'atomes, est-ce l'électricité qui maintient les atomes ensemble dans une combinaison chimique ? Autrement dit, le lien chimique responsable de "l'affinité" serait-il d'origine électrique ?
Pour l'instant on est toujours plus ou moins englués dans qui est quoi...
Lavoisier avait proposer son tableau d'éléments en 1789 et c'était déjà pas mal !
Là vers 1820, on pousse le raisonnement en essayant de recréer des substances connus à partir de combinaison des éléments C (Carbone), H (hydrogène), O (oxygène), P (phosphore), N (azote).
C'est le début de la chimie organique.
https://fr.wikipedia.org/wiki/Chimie_organique a écrit:La chimie organique s'oppose à la chimie inorganique (minérale ou « générale »), laquelle s'occupe de l'étude des substances issues du monde minéral (la Terre, l'eau et l'atmosphère). Cette séparation tient au fait que jusqu'au début du XIXe siècle, les chimistes pensaient généralement que les composés des organismes vivants étaient trop complexes de par leur structure et que l'homme ne pouvait les synthétiser car leur formation avait nécessité l'intervention d'une « force vitale » (voir vitalisme). Ces composés étaient également particuliers du fait qu'ils pouvaient se reproduire. Ils appelèrent ces composés « organiques » et continuèrent à les ignorer.
L'essor de la chimie organique commença lorsque les chimistes découvrirent que ces composés pouvaient être abordés de façon similaire aux composés inorganiques et pouvaient être recrées en laboratoire sans avoir recours à la « force vitale »
Chimie organique et théorie de la valence
Alors ici ça devient difficile de retracer les découvertes je trouve. Le meilleur lien qui permet d'essayer de suivre serait selon moi celui-ci.
On avait remarqué que l'hydrogène avait la masse la plus faible qu'on connaissait.
Au fur et à mesure des découvertes, on va remarquer dans les formules qu'il s'attache facilement à plein de choses (comme dans H₂O, CH₄).
On va progressivement en conclure que certains atomes peuvent s'attacher à 1, 2, 3 ou 4 atomes d'hydrogène.
Cela va progressivement faire émerger la notion de valence qui va être décisive dans le tableau périodique.
Aux alentours de 1816, Eugène Chevreul commence une étude des savons à partir de différents corps gras et alcalis.
Il sépare les différents acides (acides stéariques et oléiques, auxquels il donne leur nom) qui, en combinaison avec les alcali, produisaient le savon.
En 1819, Jöns Jacob Berzélius émet l'hypothèse que les liaisons chimiques comme des interactions entre dipôles.http://isimabomba.free.fr/biographies/chimistes/dumas.htm a écrit:Dumas démontre que la masse moléculaire de certains composés organiques est directement proportionnelle à leur densité de vapeur.De cette relation, il tire une méthode fiable de détermination des masses moléculaires, en particulier celles des gaz et des liquides dont le point d'ébullition est bas. Il élabore une méthode pour doser le carbone, l'hydrogène et l'azote dans les composés organiques. Cela le conduit à développer une théorie des types, ceux-ci se révélant très proches des concepts modernes de groupes fonctionnels. Il formule une théorie de substitution après avoir observé que les propriétés de certains composés organiques subissent peu de changements lorsque leur hydrogène est remplacé par une quantité équivalente de chlore
En 1834, Jean-Baptiste Dumas et Auguste Laurent montrent que les liaisons ne sont pas de types dipolaires.
On voit dans cet article que ce n'était pas encore bien facile d'y voir clair.

En particulier, ces travaux semblent ouvrir la possibilité de la tétravalence du carbone.

Malheureusement, la tétravalence du carbone ne semble pas marcher pas avec le composé benzène C₆H₆ découvert par Michael Faraday en 1825.
Si on raisonne simplement avec des liaisons simples, avec le benzène C₆H₆, on a 6 liaisons C-C, et il reste 2 liaisons à remplir par C.
Donc, on devrait avoir C₆H₁₂ au lieu de C₆H₆. En 1866, August Kekulé proposera la possibilité de double liaison (après avoir postulé que le carbone est toujours tétravalent), ce qui résout le problème du benzène évoqué ci dessus.
Si on raisonne avec des liaisons simples et double, avec le benzène C₆H₆, on peut avoir 3 liaisons C-C, 3 doubles liaisons C=C, et il reste 1 liaison à remplir par C.
Donc, on peut bien construire une molécule C₆H₆ dans ces conditions.

Néanmoins, cela met fin à la théorie de Berzélius, qui est alors remplacée par la théorie des types (= fonction chimique).
http://scphysiques.free.fr/2nde/documents/histoire-atome2.pdf a écrit:Ses premiers travaux, proposés par Dumas, consistent en une expérimentation rigoureuse et exhaustive du naphtalène et de ses dérivés. L'énorme masse de résultats qu'il obtient, sur des corps de composition voisine avec des atomes toujours identiques, oriente sa réflexion vers l'arrangement des atomes. Partant d'une observation dont le premier mérite revient à Dumas, Laurent trouve dans les phénomènes de substitutions les arguments qui ruinent la théorie dualistique de Berzelius.
En traitant certains carbures d'hydrogène par le chlore, Dumas note en 1833, que l'halogène possède le pouvoir singulier de s'emparer de l'hydrogène et de le remplacer atome par atome. Dumas, prudent, en reste à un bilan de comptabilité : un hydrogène est perdu, un chlore est gagné. Dans le laboratoire même de Dumas, Laurent va beaucoup plus loin, il multiplie les expériences du même genre et ose affirmer que le chlore remplace au sens propre l'hydrogène, c'est-à-dire occupe la place et joue le même rôle que l'hydrogène auquel il se substitue. En 1836, faire jouer au chlore, le plus négatif des éléments, le même rôle qu'à l'hydrogène, le plus positif, c'est contester de front la théorie dualistique de Berzelius alors en vigueur et c'est tout simplement inacceptable !
Vers 1850, Marcellin Berthelot reconstitue le méthane (CH₄), le méthanol (CH₃OH), l'éthyne (C₂H₂) et le benzène (C₆H₆) à partir de leurs éléments (H/C/O qu'on connait bien depuis au moins Lavoisier).
En 1852, Edward Frankland introduit une "capacité de saturation" qui est une certaine capacité d'échange avec les autre éléments et commence vraiment à introduire la valence.
En 1858, Kekulé propose que le carbone est tétravalent et toujours tétravalent (donc qu'il faut qu'il ait toujours 4 liaisons).
Pour lui, les composés organiques sont constitués par des enchaînements d'atomes de carbone, ayant échangés entre eux, une ou plusieurs unités de saturation.
En 1860, la confusion entre atome et molécule est toujours probablement aussi forte.
Pour Kekulé, "une molécule est un groupe d'atomes parfaitement identiques ne se décomposant que dans les réactions chimiques".
https://www.persee.fr/doc/pharm_0035-2349_2007_num_94_355_6370 a écrit: Cependant, la confusion entre un atome et une molécule gène l'élaboration de nouvelles théories. En 1860, dans la plus grande incohérence, on recense, par exemple, 18 façons d'écrire l'acide acétique, Kekulé organise le premier congrès international de chimie afin de définir de façon plus précise les notions d'atome et de molécule. Durant ce congrès. il n'y a pas eu de grandes avancées, mais Cannizzaro distribua un fascicule qui explique la différence entre atomes et molécules et qui marqua la plupart des participants. En effet, ces idées ont amené Mendeleïev à se pencher sur la classification et Gerhardt à émettre sa théorie des résidus. En 1825, Faraday avait découvert un composé, appelé benzène et ayant pour formule C₆H₆. Ce dernier, qui ne satisfaisait pas à la théorie de la tétravalence du carbone posa problème jusqu'en 1866, date à laquelle, Kekulé créa la double liaison.
Spectroscopie
Alors là on commence à envoyer du lourd en termes de puissance d'analyse...
Toujours en 1860, l'optique vient en renfort de la chimie avec la spectroscopie.
L'étude des spectres lumineux permet d'identifier de nouveaux éléments jusqu'alors inconnus (césium, rubidium, thallium, iridium, lithium, gallium, samarium...)
Comment souvent, il y a plusieurs étapes au fil du temps qui commence probablement avec Newton qui découvre le spectre de la lumière à travers un prisme.
En 1752, Thomas Melvill chauffe des sels de sodium et regarde la lumière de la flamme à travers un prisme de verre, et voit une raie intense et jaune.


En 1802, William Hyde Wollaston signale que le spectre de la lumière du soleil est discontinu (avec des bandes noires) alors que d’habitude il est continu avec d'autres sources lumineuses.
Ces raies ne changent pas de position quel que soit le prisme utilisé. Ça semble donc être une signature.
- Quelles sont les sources qui sont continues si le soleil ne l'est pas ?:
- Si comme moi, vous avez été laissé sur le carreau à l'école.
Ce qui émet un spectre continu "complet" à notre œil est par exemple quelque chose qui émet une lumière blanche, comme le filament d'une lampe chauffé fort par effet Joule lors du passage du courant.
Sinon il peut être continu aussi (ie. sans raie noire) mais incomplet (auquel cas il manquerait certaines longueurs d'onde comme le bleu). C'est le cas des braises, du métal travaillé dans une forge (quoi qu'il puisse devenir presque blanc si on le chauffe trop).http://spc.emde.free.fr/fichiers/seconde/Chapitre_4.pdf a écrit:Quand la température d’un corps (solide, liquide ou gaz sous forte pression) augmente, sa couleur passe du rouge (orangé) au jaune puis au blanc. Lorsqu’il est fortement chauffé, il émet un rayonnement d’origine thermique dont le spectre est continu. L’intensité de chaque radiation du spectre ne dépend que de la température: plus le corps est chaud et plus il s’enrichit en radiation de courte longueurs d’onde (radiations bleues).
En 1814, Joseph Von Fraunhofer regarde le spectre du soleil et des étoiles à travers d'un petit télescope et constate aussi la présence de ces raies noires. Il s'en sert pour proposer une manière de mesurer les longueurs d'onde en prenant ces raies comme référence.

En 1860, Robert Wilhelm Bunsen (qui invente le bec Bunsen au passage) et Gustav Kirchhoff étudient les eaux minérales qui contiennent probablement des sels minéraux.
Ils constatent que les raies spectrales sont caractéristiques des sels, cumulatives et sensibles, et prédisent qu'elle permettra de découvrir de nouveaux éléments.
Kirchhoff remarque que si une lumière blanche intense (qui devrait normalement donner un spectre continu) traverse la flamme de sodium et est analysée, on observe une raie noire là où on aurait eu un raie jaune si on avait chauffé du sodium et regarder directement la lumière du sodium chauffer (comme Melvill en 1752).
Cela lui permet d’interpréter les raies de Fraunhofer comme étant l'absorption de la lumière par les éléments que contiennent les corps célestes.
Un spectre lumineux nous renseigne sur la température de la matière chauffée qui émet cette lumière.
Plus c'est chaud, plus la lumière est blanche. Si la lumière a une couleur (par exemple, légèrement jaune pour le soleil) alors il manquera certaines longueurs d'onde (voir un peu plus haut dans le spoiler).
S'il y a des raies noires, il y a donc des gaz sur le trajet de la lumière qui créent ces bandes. On ne sait pas trop où à priori (notre atmosphère, autour du soleil, entre le soleil et nous) mais ça doit exister !
Ils comprennent rapidement l'importance de cette analyse, qui cascade de nouvelles découvertes juste après
"L'analyse par le spectre offre aux investigations de la chimie un champ jusqu'à présent inexploré et dont les limites s'étendent même au-delà de notre système solaire. Comme cette nouvelle méthode d'analyse n'exige que l'observation par la vision d'un gaz incandescent, on comprend facilement qu'elle doit être applicable à l'atmosphère du soleil et à celle des étoiles fixes."
En 1860, ils découvrent puis isolent le césium. En 1861, le rubidium.
En 1861, William Crookes découvre le thalium.
En 1863, Ferdinand Reich et Jeremias Benjamin Richter découvrent l'iridium.
En 1865, Bunsen isole le lithium.
En 1875, Paul Lecoq de Boisbaudran découvre le gallium puis le samarium (1879)
Classification des éléments
La nécessité de classer les éléments connus alors redevient pressante.
Plusieurs essaieront de proposer une classification pertinente mais c'est finalement Dmitri Mendeleïev qui va proposer la classification périodique des éléments qui va lentement converger vers celle que nous connaissons.
Mais pour en arriver là, les scientifiques vont bien tâtonner encore.
On a vu apparaître des essais de premières tables (Geoffroy en 1718, Lavoisier en 1789) mais le regroupement était surtout sur les propriétés et les affinités.
Désormais, on a plusieurs indicateurs qui nous permettent de parler de similitudes tangibles entre les éléments
- Température de fusion: on regarde à quelle température le métal se met à fondre
- Densité du matériau: par exemple on s'arrange pour fondre un métal dans un dé de 1cm3 et on prend sa masse
- Masse atomique: depuis 1808 avec Dalton, on avait calculé les masses atomiques relatives par rapport à l'hydrogène de ces éléments connus (grâce à la loi d'Avogadro-Dalton qui permet de déterminer le poids atomique d’après la densité gazeuse).
Dès 1817, Johann Döbereiner essaie de regrouper les éléments par triades selon leurs propriétés et un constat mathématiques de demi-somme
- En 1817, la triade alcalino-terreux avec Ca(40), Sr(88) et Ba(137) car 88 ≈ (40+137)/2
- En 1829, les triades halogènes avec Cl(35,5), Br(80), I(127) et métaux alcalins avec Li(7), Na(23), K(39)
- En 1850, 20 triades ont été trouvées
En 1859, Jean-Baptiste Dumas ajoute un quatrième élément à la tétrade et abonne la moyenne arithmétique au profit d'une progression "similaire" d'une tétrade à l'autre.
Par exemple:

Donc on est en train de dire qu'à la louche, et si on regarde les poids atomiques, on passe
- du 1er au 2ème élément en ajoutant environ 16
- du 2ème au 3ème élément en ajoutant environ 46
- du 3ème au 4ème élément en ajoutant environ 48
Ça peut sembler approximatif mais ça marche sur plus d’éléments que les triades. Et on voit arriver un nombre qui mesure une période entre des éléments.
Quand on commence à remarquer que chaque élément semble avoir un masse atomique unique, une première clé de tri semble donc s'imposer naturellement : leur masse atomique croissante.
En 1862, Alexandre-Émile Béguyer de Chancourtois classe les éléments chimiques alors connus en fonction de leur masse atomique déterminée en 1858 par le chimiste italien Stanislao Cannizzaro.
Il normalise par rapport à l'oxygène au lieu de l'hydrogène et crée un cylindre sur lequel on voit de plus en plus arriver la périodicité.
Il retrouve certaines triades et tétrades alignées (ex: O:16, S:32, Se:79, Te:128)

En 1866, John Alexander Newlands s'aperçoit, en classant les éléments par ordre croissant de poids atomiques, d'une répétition de propriétés tous les 7 éléments (loi des octaves)
Il les classe dans un tableau à sept lignes en les arrangeant de telle sorte que leurs propriétés chimiques soient similaires par lignes, sans hésiter à placer deux éléments dans une même case si nécessaire pour éviter de laisser des cases vides par ailleurs. Il avait apparemment pressenti que le tableau n'était pas complet, et par exemple prédit un nouvel élément, le futur germanium, dans une triade Si(28), ?(~70), Sn(118) mais n'avait pas prévu de place pour lui dans son tableau.
Et chose beaucoup plus gênante, il avait un problème de périodicité comme Chancourtois, car si les éléments légers connus à l'époque avaient bien une périodicité chimique tous les sept éléments, cela cessait d'être valable au-delà du calcium. En d'autres termes, les éléments

En 1860, William Odling propose une classification proche de celle publiée par Mendeleïev avec des cases vides là il n'y a pas d'éléments.

En 1864, Julius Lothar Meyer publie une première version du tableau périodique en 6 familles

En 1868, il propose un second tableau qui est une véritable classification périodique
À l'aide d'un première publication de Mendeleïev qu'il découvre la périodicité des éléments en traçant graphiquement le volume atomique, en fonction du poids atomique.
Meyer avait également remarqué que si l'on trace une courbe représentant en abscisse la masse atomique et en ordonnée le volume atomique de chaque élément, cette courbe présente une série de maxima et de minima périodiques, les maxima correspondant aux éléments les plus électropositifs.

- Comment connaissaient-ils le volume atomique ?:
- Bah oui tiens. On fait un graphique avec les masses atomiques et les volumes.
On a vu qu'on connaissait les masses atomiques relatives (on savait par exemple que Li est 7x plus lourd que H, sans connaitre la masse intrinsèque de H pour autant).
Mais d'où sort le volume atomique ?Die Natur der chemischen Elemente als Function ihrer Atomgewichte; von Lothar Meyer a écrit:L'une des propriétés qui change assez régulièrement avec le poids atomique est le remplissage spatial des éléments, le volume atomique. Le tableau III donne une représentation graphique de ses variations en fonction des variations des poids atomiques. En abscisses de la courbe sont portées les hauteurs proportionnelles aux poids atomiques, en ordonnées celles qui sont proportionnelles aux volumes atomiques correspondants des éléments à l'état solide (à l'état liquide seulement pour le chlore), c'est-à-dire les quotients du poids atomique et de la densité. Le poids atomique de l'hydrogène et la densité de l'eau sont utilisés comme unités.
On a en général densité = masse / volume, soit en particulier
densité = masseAtomique / volumeAtomique
volumeAtomique = masseAtomique / densité
Donc si on connait les densités des solides, on en déduit facilement les volumes atomiques.
FIXME: comment sait-on les densités alors qu'une bonne partie est en gaz ?
- Comment détecte-t-on une périodicité ?:
- Alors si comme moi, c'était pas forcément clair comme on peut détecter une périodicité ici, voici un schéma plus sympa pour comprendre.
Quand on est dans une ligne (période donnée), on a un nombre donné de couches électroniques autour du noyau.
Quand on augmente la masse atomique (ie. quand on avance de gauche à droite sur une ligne), on augmente la masse de l'élément.
Cette augmentation de masse se fait principalement par le noyau car le nombre de protons augmente (le nombre de couches électroniques reste fixe, et on prend un électron en plus mais ça ne change quasiment pas la masse). La charge positive du noyau tire donc de plus en plus les électrons vers l'intérieur, réduisant progressivement le rayon atomique.
Réciproquement, si on revient en arrière, le rayon atomique augmente : c'est la flèche rouge sur le schéma.
Quand on augmente la période, cela revient à ajouter des électrons autour du noyau. Ils ont donc de grandes chances de se trouver loin du noyau comme il y a déjà plein autour du noyau de la période d'avant.
Cela augmente donc le rayon atomique : c'est la flèche verte.
À vrai dire, ça aurait très bien pu ne pas augmenter le rayon des éléments de la 1ère colonne (qui aurait pu rester à 200pm).
Mais bon c'est le cas, et si on change de période, on a une cassure marqué avec le gaz saturé de la dernière colonne d'avant (exemple, He → Li, Ne → Na, etc.).
Cela marque la périodicité de manière assez nette.

En 1871, Mendeleïev publie sa table avec 8 affirmations
- Les éléments, arrangés dans l'ordre croissant de leur poids atomique, montrent clairement une périodicité.
- Les éléments chimiques ayant des propriétés chimiques semblables, ont des poids atomiques qui ont environ la même valeur ou bien des poids atomiques qui augmentent régulièrement.La loi périodique (1869) a écrit:Les propriétés des corps simples et composés dépendent d’une fonction périodique des poids atomiques des éléments, pour la seule raison que ces propriétés sont elles-mêmes les propriétés des éléments dont ces corps dérivent
- L'arrangement des éléments ou des groupes d'éléments dans l'ordre de leur poids atomique correspond à leur valence (la notion de valence sort de la Chimie Organique).
- Les éléments les plus abondants dans la nature ont des poids atomiques petits, et des propriétés bien définies. Ce sont des éléments types.
- La valeur du poids atomique détermine le caractère (la réactivité) d'un élément.
- On peut prévoir l'existence d'éléments inconnus (les ? en orange ci-dessous)
- Certains poids atomiques seront probablement corrigés.
- Ce tableau révèle de nouvelles analogies entre des éléments.

C'est pas forcément évident de retrouver le tableau périodique actuel.
Mais quand même, quel tour de force d'arriver à faire ressortir les 6 premières périodes...
Apparemment, le secret de sa réussite a été la décision de comparerhttps://www.elementschimiques.fr/?fr/decouverte/classification-periodique a écrit:Il observa une périodicité de ces propriétés lorsqu’il les classa suivant leur masse atomique croissante et entreprit alors de placer les éléments ayant des propriétés voisines sous forme de colonnes. Le premier élément de chaque ligne ou période étant un métal alcalin et le dernier un halogène. Il eut l’idée de renverser les positions (définies par leur masse) de l’iode et du tellure en se référant plutôt à leurs propriétés physico-chimiques
- les halogènes du futur 17ème groupe = F/Cl/Br/I
- et les métaux alcalins du futur 1er groupe (sauf H) = Li/Na/K/Rb/Cs
C'est pas très clair tout ça... J'avoue que je ne vois pas trop les étapes ici.

En attendant, essayons de retourner tout ça (en gros une rotation de 90° et une symétrie d'axe vertical) pour mieux comparer avec qu'on connait maintenant.


On voit que si on regarde juste la période (le numéro de ligne, donc le futur nombre de couches électroniques), il y a peu d'erreurs (en rouge).
Également il a mis des ? avec des masses attendues à certains endroits.
Comment a-t-il su ? Et pourquoi pas partout où il y avait des trous ?
Prenons les deux accolés qu'il a mis entre ses Zn(65.2) et As(75).
On a vu que plus haut que les tétrades prenaient un ordre de grandeur à la louche entre les périodes.
Si on se place juste avant et après on a respectivement 65.2-24 = 41.2 et 75-31 = 44.
Si on prend, aller 42, on a donc 27.1 + 42 ≈ 68 et 28 + 42 = 70 pour ces deux éléments hypothétiques.
Pareil pour le dernier à gauche de Ta, Ta - Nb = 88 donc 90 + 88 ≈ 180 pour ce dernier élément hypothétique.
Après il a eu raison de ne pas insister de trop car entre Hg et Au par exemple, il y avait des incertitudes de précision.
Ils sont en fait accolés dans la table qu'on connait actuellement.
En plus d'avoir prédit leur masse atomique, il a réussi aussi à prédire leur densité et d'autres caractéristiques

Vers 1900, on a apparemment identifié les éléments suivants

Dernière édition par stv82 le Sam 29 Mai 2021 - 19:16, édité 38 fois
stv82- Messages : 501
Date d'inscription : 28/01/2015
Localisation : Alpes du Nord
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Modèle atomique de Thomson
À cet instant, on pense encore que les atomes sont les particules fondamentales de la matière.
C'est J.J. Thomson qui viendra semer le doute en 1897 en faisant des expériences sur les tubes cathodiques.
Dans un tube en verre sous vide, un fort champ électrique crée un faisceau lumineux.
C'est assez perturbant... En principe, on est dans ce qu'on pense être du vide (je dis en principe car avec l'énergie noire et tout, je ne suis plus sûr de rien maintenant) et pourtant quelque chose semble se déplacer de l'anode vers la cathode. Cela provoque un faisceau de lumière qui projette une ombre sur le fond du tube et on peut perturber et dévier ce faisceau avec un aimant.
- Tube de Crookes:
Si on arrachait du métal de l'anode, ce métal devrait se retrouver au fond du tube et l'anode perdrait en volume avec le temps.
Thomson se dit probablement qu'il doit y avoir une particule différente des atomes mais que ceux-ci doivent pouvoir libérer si besoin.
Thomson a la bonne idée de le soumettre à un champ électrique, ce qui lui permet de déterminer sa charge : négative.
Il l'appelle électron et cela lui permet de proposer le modèle atomique de Thomson.
Il voit l'atome comme un gâteau avec des raisons dedans (plum pudding).
Personnellement, avec l'image de l'aimant en tête, j'aurais été plus tenté par des billes qui viennent s'aimanter à l'extérieur du noyau et qu'on peut donc plus facilement décrocher grâce au champ électrique.
Enfin, ça nous donne quelque chose comme ça :

Modèle atomique de Rutherford
À cet instant, on s'imagine probablement toujours que la matière, quand il y en a, est "pleine" (cf. modèle de Thomson)
Puis, on se rend compte que certains matériaux radioactifs viennent marquer ou faire scintiller certains autres matériaux (par exemple en les oubliant ensemble dans un tiroir).
Ça n'est pas systématique mais parfois, un écran spécial placé dans le noir semble frapper par "quelque chose" et scintille brièvement.
Si on les met dans une boîte longue avec un petit trou, on peut donc fabriquer des canons directionnels qui font sortir ces choses dans une direction souhaitée.
On n'est pas sûr que la particule est élémentaire mais le fait qu'elle ne sorte qu'épisodiquement du matériau semble appuyer cette hypothèse.
Sur ce, Rutherford et al. ont l'idée de placer une feuille d'or en travers d'un de ces canons à particule alpha qui fait normalement scintiller l'écran juste devant lui. Naïvement on s'attendrait à ne rien voir car la feuille devrait arrêter la particule.
En fait, la plupart du temps, la particule passe à travers sans être déviée.
Mais parfois (1 fois sur 8000) elle semble être déviée voire carrément rebondir et repartir en arrière ! En tout ceci, en plus dans des directions complètement aléatoires.

Comme les très rares impacts latéraux semblent distribués partout sur le détecteur, ça semble séduisant d'imaginer la matière complètement vide avec des billes par ci par là.
Si on a du bol de toucher une bille, on peut alors repartir en arrière si le choc est plutôt frontal ou se faire légèrement dévié si le choc est latéral.
Bon, la matière semble donc trouée. Ah bah elle est pas mal celle là...
Et l'être humain de s'apercevoir que du haut de sa toute puissance, il n'est en fait que du vent

Cette découverte va relancer l'étude des réactions chimiques des siècles passés.
On va progressivement faire le lien avec les électrons, les anions, le cations et formaliser réellement l'oxydo-réduction.
https://fr.wikipedia.org/wiki/R%C3%A9action_d%27oxydor%C3%A9duction a écrit:Mais ce n'est qu'au XXe siècle, après la découverte de l'électron (Joseph John Thomson, 1897) et l'introduction du modèle atomique de Bohr (1913) que les réactions chimiques sont réexaminées à la lumière de ces nouveaux modèles et que des similitudes observées permettent de dégager progressivement le concept actuel d'oxydoréduction qui s'exprime en termes de transferts d'électrons.
https://fr.wikipedia.org/wiki/%C3%89lectrolyse_de_l%27eau a écrit:L'électrolyte se dissout et se dissocie en cations et anions (c'est-à-dire respectivement des ions chargés positivement et négativement) qui peuvent « porter » le courant. Ces électrolytes sont habituellement des acides, des bases ou des sels.
On reste sur le fait que ce sont les électrons qui bougent et qui sont les vecteurs de l'électricité, le noyau doit rester stable.
Soit les électrons sont par défaut collés au noyau par l'attraction -/+ comme dans le modèle de Thomson, soit ils gravitent autour du noyau pour ne pas s'écraser et se font peut-être éjecter si on les bouscule.
On se dit peut-être qu'un modèle planétaire semble pertinent comme on connait ça dans la nature, et cela permet de proposer le modèle atomique de Rutherford
Les électrons de charge négative "orbiteraient" à la périphérie de l'atome, attirés par le noyau de charge positive mais ils sont loin du noyau et surtout loin les uns des autres: ils conservent une distance de sécurité mais peuvent se faire arracher à la demande comme ils sont à l'extérieur.
Subatomique++/Physique des particules
(En cours de rédaction)
Le noyau est constitué de protons qui sont chargés et de neutrons sans charges
Donc le noyau est complètement positif et devrait "exploser" comme les protons se soumettent mutuellement à la répulsion électrostatique, et que les neutrons sont insensibles aux force électriques.
C'est l'interaction forte ou force nucléaire forte, puissante attraction de courte portée qui arrive à les lier ensemble lorsqu'ils sont suffisants proches.
Or la répulsion électrique des protons est gigantesque, et d'autant plus qu'ils sont nombreux (numéro atomique élevé). Même l'interaction forte a du mal à contrer la force de répulsion. Grâce aux neutrons qui n'ajoutent pas de charges + et donc pas de répulsion supplémentaire, mais qui participent à la force nucléaire forte, le noyau reste stable.
La présence des neutrons favorise l'union du noyau atomique, sans ajouter de disruption due à la charge électrique. Ils peuvent donc être considérés comme une sorte de ciment qui donne une consistance aux noyaux atomiques. Sans l'intervention de ces discrètes particules, les noyaux voleraient en morceaux.
Les noyaux atomiques les plus lourds qui comptent le plus de protons, ont besoin d'une force nucléaire plus élevée pour assurer leur cohésion; ils tendent, par conséquent, à posséder plus de neutrons que de protons à mesure que le numéro atomique augmente.
Ensuite, on commence à avoir des problèmes car les électrons ne vont pas vraiment se comporter comme des planètes.
Ils sont distribués selon des positions discrètes et semblent sauter d'orbites sans transition continue.
Ensuite, si on continue de descendre encore avec des accélérateurs de particules, on essaie de casser ce petit monde et voir ce qui en sort pour voir de quoi c'était fait.
Ça amène plein de questions et de théories dont la célèbre théorie des cordes.
https://fr.wikipedia.org/wiki/Th%C3%A9orie_des_cordes
Dernière édition par stv82 le Sam 29 Mai 2021 - 19:08, édité 2 fois
stv82- Messages : 501
Date d'inscription : 28/01/2015
Localisation : Alpes du Nord
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Oh dans quoi je me suis embarqué encore 
J'ai du mal à passer de la vision chimique (où on est pas encore sûr de qui est élémentaire ou non) au tableau périodique (où on connait bien les éléments atomiques). Ça a l'air d'avoir beaucoup bougé vers 1800 avec l'électrolyse.
Mais il me semble que ce sont les raies d'absorption avec le prisme qui ont permis de vérifier de manière tangible les signatures des constituants des gaz. Bon, ça finira bien par monter au cerveau un jour !
Bon sinon, c'est dommage, je suis bien sûr qu'il y a forcément un autre clampin qui aurait fait un bon bouquin avec les différentes étapes. S'agirait de le trouver quoi. Pour l'instant, le mieux que j'ai trouvé c'est ça : http://scphysiques.free.fr/2nde/documents/histoire-atome2.pdf
Ça couvre de Lavoisier à Bohr et c'est déjà bien intéressant !

J'ai du mal à passer de la vision chimique (où on est pas encore sûr de qui est élémentaire ou non) au tableau périodique (où on connait bien les éléments atomiques). Ça a l'air d'avoir beaucoup bougé vers 1800 avec l'électrolyse.
Mais il me semble que ce sont les raies d'absorption avec le prisme qui ont permis de vérifier de manière tangible les signatures des constituants des gaz. Bon, ça finira bien par monter au cerveau un jour !
Bon sinon, c'est dommage, je suis bien sûr qu'il y a forcément un autre clampin qui aurait fait un bon bouquin avec les différentes étapes. S'agirait de le trouver quoi. Pour l'instant, le mieux que j'ai trouvé c'est ça : http://scphysiques.free.fr/2nde/documents/histoire-atome2.pdf
Ça couvre de Lavoisier à Bohr et c'est déjà bien intéressant !
stv82- Messages : 501
Date d'inscription : 28/01/2015
Localisation : Alpes du Nord
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Intéressant, j'ai commencé à lire. 
Sylph- Messages : 249
Date d'inscription : 20/04/2021
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Un autre lien sympa avec une vision historique synthétique et ordonnée dans le temps.
Il n'y a beaucoup de détails mais ça devrait pouvoir aider à ordonnancer ce bazar !
http://isimabomba.free.fr/histoire/historique.htm
Il n'y a beaucoup de détails mais ça devrait pouvoir aider à ordonnancer ce bazar !
http://isimabomba.free.fr/histoire/historique.htm
stv82- Messages : 501
Date d'inscription : 28/01/2015
Localisation : Alpes du Nord

So Sûre 2- Messages : 6805
Date d'inscription : 08/08/2020
Age : 53
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
- Je ne sais pas grand chose....:
Mais j'ai lu ces informations que je trouve intéressantes :
https://comptes-rendus.academie-sciences.fr/chimie/item/CRCHIM_2020__23_3_221_0/
https://www.utinam.cnrs.fr/?Histoire-de-la-classification-des-elements-1747
https://culturesciences.chimie.ens.fr/thematiques/histoire-de-la-chimie/la-classification-periodique-de-lavoisier-a-mendeleiev
Un article intéressant même si pas assez sourcé :
https://fr.wikipedia.org/wiki/Histoire_de_la_d%C3%A9couverte_des_%C3%A9l%C3%A9ments_chimiques
L'importance de la spectroscopie-spectrométrie :
Kirchhoff et Bunsen (avec lesquels Mendeleiev a travaillé) ont développé l’analyse spectrale, qui permet d’observer les raies d’émission de divers corps. La lumière est décomposée par un prisme et le spectre présente des bandes caractéristiques des éléments contenus dans l’échantillon.
Cette méthode a permis dès son invention la découverte de nouveaux éléments chimiques
et une meilleure connaissance des éléments connus, de repérer leur présence dans certains échantillons.(Puis les méthodes de séparations et d'extraction se sont perfectionnées.)
L'analyse spectrale a permis de repérer des affinités chimiques et de compléter le tableau de Mendeleiev.
Quand tu seras arrivé à étudier l'état quantique des particules, je serais intéressée de savoir à partir de quand tu penses qu'une particule existe physiquement malgré son état indéterminé (ou son absence d'état, ou sa densité de probabilité d'états qui définit une existence virtuelle mathématiquement), notamment en relation avec le paradoxe EPR.
-----------
Sur l'élémentarité et les quanta...
La quantité "de base" n'est ni une masse ni une énergie ni une particule...
http://www.matierevolution.fr/spip.php?article3572
http://www.matierevolution.fr/spip.php?article38
La matière et la lumière sont deux phénomènes dialectiquement opposés, c’est-à-dire des inverses inséparables. Pas de communication entre matières sans échange de lumière (les physiciens disent des photons ou des bosons pour "lumière" ou encore des particules d’interaction). Pas de matière sans entourage de photons dits virtuels. Pas de perception de ces photons sans matière. Matière et lumière manifestent d’autre part une unité impressionnante. Ils sont tous deux faits de quanta d’action. La matière émet et absorbe de la lumière. Ils obéissent identiquement aux lois quantiques avec notamment cette étonnante propriété de dualité onde/corpuscule, cette non moins étonnante propriété de pluralité des états et enfin celle des sauts quantiques. Cependant, matière et lumière s’opposent. les uns obéissent à une logique attractive (les bosons) et les autres à une logique répulsive dite principe de Pauli (les particules matérielles). Cela signifie que les particules de lumière ont tendance à se grouper entre photons qui sont en phase et les particules ne peuvent exister dans un même état.
Tous deux sont des structures et des rythmes issus des interactions en tous sens et en permanence d’un grand nombre d’oscillateurs dipolaires couplés que sont les couples de particules et de leurs antiparticules virtuelles du vide quantique.
Ni la lumière ni la matière, même dans leurs manifestations dites élémentaires (un seul corpuscule) ne sont des objets. Ce sont des phénomènes d’émergence de structure et de rythme. Ils sont fondés sur un grand nombre de particules virtuelles et de photons virtuels.
On a longtemps cru que la réalité était décrite par des objets, les atomes ou les particules. Il s’agissait de « choses », c’est-à-dire d’éléments fixes qui étaient caractérisés par des paramètres constants. On parlait de charge de l’électron, de masse de l’atome ou de trajectoire (vitesse et position) d’une particule. Tout cela a dû être abandonné devant les découvertes de la physique quantique. Quelle image ressort finalement de ce grand chambardement ? Aucune, diront certains.
Sur l'électron comme particule élémentaire, et sur le vide comme constituant (*) de la matière :
(participe présent, le vide est agissant et constituant/créateur car il ne faut pas oublier que la matière est sortie du vide quantique au big bang)
l'électron est constitué de sa propre interaction avec le vide (espace-temps nu contenant les particules virtuelles par paires qui se produisent et s'annihilent = fluctuations) dans son propre champ électromagnétique
Michel Paty dans « Nouveaux voyages au pays des quanta » : a écrit:
« L’électron interagit avec les « paires virtuelles » de son propre champ électromagnétique. (…) Le vide quantique contient de telles paires virtuelles et cet effet a été observé sous le nom de « polarisation du vide ». L’électron se trouve interagir avec la charge d’un des éléments de la paire virtuelle, en sorte qu’un électron quantique n’est jamais « nu » mais « habillé » d’un essaim ou nuage de paires virtuelles qui polarisent son environnement immédiat et modifient, par voie de conséquence, ses niveaux d’énergie. (…) La procédure dite de renormalisation considère que la masse et la charge physique de l’électron sont celles de l’électron « habillé » et non celles de l’électron « nu ». ce dernier n’existe pas réellement, puisqu’il est toujours impensable sans son champ. »
Comme quand on regarde au niveau atomique pour les atomes qui peuvent se lier et s'agiter, en phases différentes (états différents) selon la température (gaz - liquide - solide), au niveau quantique, les particules (qui ne sont pas des objets et qui seraient une sorte d'énergie structurée de façon indivisible) ont des phases et des transitions entre virtualité et réalité qui correspondent aux états quantiques.
(En simplifiant d'après ce que j'ai cru comprendre : )
Même pour le photon, si on sait qu'il n'est pas un corpuscule, il en a le comportement, son quanta est insécable est assimilable à un corpuscule. Les photons interagissent avec la matière, depuis le big bang. Le photon est le "résultat" de l'interaction du champ électromagnétique avec l'espace-temps, il est ponctuel mais il interagit en au moins deux dimensions (pas vraiment spatiales mais assimilées : longueur d'onde et amplitude) même si la lumière est censée se déplacer en ligne droite donc en une dimension (portée par des photons sans dimension).
L'électron n'est pas non plus vraiment matériel, il n'a pas non plus vraiment de spin mais il se comporte comme si.... Il est également issu des interactions du champ électromagnétique et du champ de l'interaction faible avec l'espace-temps, il présente une charge électrique sphérique, en trois dimensions.
Les nucléons résultent de l'interaction nucléaire forte (qui a "produit" et lié les quarks et donc qui a "produit" et lié les neutrons et protons) avec l'espace-temps.
(L'interaction faible qui est localisée au noyau atomique permet les échanges d'énergie, de masse et de charge électrique).
Les interactions existent sous forme de champs, les quanta et particules sont les "résultats" des interactions fondamentales avec l'espace-temps, ils ont permis à la matière de s'extraire du vide (de son énergie noire pas vraiment physique), aux particules d'échapper à la symétrie des paires et aux fluctuations, et ils permettent aux états de la matière de s'extraire du virtuel.
La matière ayant été produite au big bang, essentiellement sous forme d'atomes d'hydrogène (sortie de la virtualité de la matière à partir du vide constitué d'énergie noire, c'est à dire à partir de l'énergie de l'espace-temps nu), ainsi que les photons (comme quanta/bosons), seul les échanges de matière-énergie résultent depuis lors des interactions fondamentales, lors de transformations qui passent elles-mêmes du virtuel au réel (en passant aussi par des particules virtuelles hypothétiques servant virtuellement d'intermédiaires pour les échanges d'énergie et les changements d'état mais la quantité de matière est conservée ainsi que l'énergie).
(quoi que la conservation de la matière est remise en cause par exemple à l'horizon d'un trou noir nu dont la force de marée pourrait séparer une paire de particule-antiparticule en éjectant au loin une particule qui passerait de la virtualité à la réalité (= qui ne pourrait plus fluctuer entre réalisation et annihilation par son antiparticule), tandis que son antiparticule serait absorbée par le trou noir... hypothétiquement. La conservation d'énergie serait possible par un rééquilibrage sous forme d'évaporation du trou noir ou lors du firewall)
(En fait, toute ces explications disent que la matière s'est crée d'elle-même à partir de l'énergie du vide en sortant de la virtualité.
Et que les états des spins des électrons ne sont pas forcément causés par une cause, notamment dans les systèmes de particules intriquées, que les états sont corrélés mais indéterminés jusqu'à l'observation d'un état de l'une au moins des particules intriquées sans qu'une cause n'explique l'état observé. A ce niveau, c'est la mesure qui fait sortir l'état du système inséparable de son indétermination : la réalité de l'état sort de la virtualité d'état qui était une superposition de deux états antagonistes)
Alors à partir de quand on entre dans la physique ? A partir de combien de dimension ? et à partir de quelle virtualité/réalité.
Perso, je dirais qu'on y entre dès qu'on sort de la virtualité des fluctuations. Et je penche pour une action sur deux dimensions spatiales (impliquant des "objets" possédant au moins deux dimensions).
Avant, on est dans l'abstrait et dans les maths (le point, le rayon à une dimension, le virtuel, le quantique potentiel hypothétique et imaginaire...).
(Même l'énergie noire ne peut pas vraiment être considérée physique puisque non observable ; la physique est une science de l'observation. On observe les effets de l'énergie noire mais pas l'énergie noire dans ses causes, elle est censée préexister au big bang, c'est différent. De même on observe les "effets" de la superposition quantique mais la superposition et le "déclenchement" de la réalisation d'un état d'une particule n'est pas physique tel qu'ils sont expliqués ; il s'agit d'un principe hypothétique appelé hasard pur qui ressemble à un principe magique si on lui fait déclencher un état à partir d'une équiprobabilité, c'est à dire d'aucune cause particulière, donc ex-nihilo. Les "effets" du hasard sont physiques mais le principe du hasard ne l'est pas en tant que non cause)
Je sais que beaucoup de scientifiques aiment le hasard et qu'ils ne seront pas d'accord avec moi. Tant pis.
(Je veux bien parler d'hypothétique en physique, mais par exemple dans le cas des forces inertielles, de l'énergie potentielle mécanique, quand on peut formaliser les causes et effets clairement, même si on n'a pas démontré le principe d'équivalence. Par contre, parler de particules virtuelles, ou d'état indéterminé ou superposé, ça ressemble trop à de la pensée magique, de plus, souvent sans causes définies avec des effets probabilistes. je trouve que ça n'a pas vraiment sa place en physique, seulement en maths, tant que les axiomes sont bien posés, ils peuvent rester hypothétiques dans un raisonnement également hypothétique)
Edit :
J'ai rajouté un petit passage sur le hasard. Désolée, je n'ai pas pu m'empêcher...
C'est mon petit côté einsteinien

Sinon, au cas où, pour la gerbe, je la préfère fleurie

(cette dernière remarque n'est pas destinée à stv82
- Edit 2:
stv82
Je ne veux pas t'embêter ; je voulais surtout profiter de tes recherches, au cas où tu trouverais des infos qui m'intéresseraient particulièrement. Et aussi peut-être que tu donnes ton avis si tu en as un (on n'est pas tous obligés d'avoir un avis sur tout )
)
Je sais que la physique propose des modèles basés sur des formalisations mathématiques. Ce n'est pas un problème en soi, au contraire même. Je sais que les forces sont modélisées par des vecteurs en une direction avec des points d'applications... Ce n'est pas gênant tant qu'on sait qu'il s'agit d'un modèle.
On sait bien qu'on fera agir la gravitation au centre de gravité, mais on sait aussi bien que le centre de gravité n'existe pas physiquement en soi.
On ne sait même pas vraiment si la gravitation courbe l'espace ou si elle n'est que la courbure.
Pour en revenir à l'infiniment petit, l'émergence de la matière à partir de l'énergie noire est incompréhensible. Au big bang, tout émerge pratiquement en même temps sans qu'on sache identifier une cause : les interactions émergent en même temps que l'espace-temps et les particules, de sorte qu'on ne peut pas dire si ce sont les interactions fondamentales qui ont produit l'espace-temps ou l'inverse, ou si l'espace-temps a fait émerger la matière ou l'inverse. Tout s'est produit en même temps. Donc quand on veut observer l'émergence de la matière, on l'explique par l'interaction des forces fondamentales avec l'espace-temps, mais on pourrait aussi bien dire que c'est la matière qui était virtuellement dans le vide qui a désunifié de l'énergie noire en faisant émerger les interactions et l'espace-temps. On est dans un emboîtement de niveaux incompréhensibles : l'univers est constitué de matière (je ne parle même pas de la matière noire), d'interactions fondamentales, et d'espace-temps. Mais on ne sait pas si la matière est dans l'espace-temps ou si elle interagit avec par les forces fondamentales, on n'a même aucune idée de ce qu'est l'espace-temps (on a abandonné l'idée d'ether au profit d'une sorte de maillage qui ne peut pas exister sans matière).
On reproduit l'absence de causalité originelle à chaque interprétation quantique. Mais c'est un raisonnement purement mathématique.
Et ce raisonnement n'explique pas le paradoxe EPR ; il ne fournit qu'une interprétation du phénomène observé comme "non effet", la cause est annulée.
Je pense qu'en physique, pour expliquer, il faut avoir une logique de cause à effet. Si on n'a des phénomènes sans causes, ce ne sont plus des "effets", ce sont des phénomènes magiques. Dans le hasard pur, des causes équiprobables sont une non cause qui produit un non effet. C'est purement mathématique. On ferait mieux de proposer une explication sur la non localité, ou au moins proposer un autre mot que celui du hasard.
Tant qu'on ne saura pas comment la matière qui a émergé du vide a gagné sur l'antimatière, on restera bloqué sur une équiprobabilité intrinsèque à l'impossibilité d'identifier une cause première.
Si c'est le hasard qui a "déclenché" l'existence de la matière, de l'espace-temps et des interactions fondamentales, le hasard préexistait à l'univers dans l'énergie noire. Mais qu'est-ce que ça veut dire préexister ? Combien de temps avant l'apparition du temps ce hasard a-t-il été virtuel avant de se déclencher ?
Et comment des paires de particules qui fluctuent dans le vide (zones d'espace-temps nu dans notre univers) peuvent-elles exister si elles sont virtuelles ?
Il faudrait définir clairement à partir de quand on peut parler d'existence, d'existence physique...
Si on creuse pour aller vers l'infiniment petit, on va tellement loin qu'on y trouve de la virtualité et puis surtout qu'on y trouve plus rien. Et c'est ce rien qui expliquerait tout... (et qui nous fait comprendre qu'on n'a rien compris et qu'on n'a jamais vu la profondeur de l'infiniment petit)
Le plus petit quanta d'existence à l'origine de la matière est-il un quanta de hasard ? de non cause ?
Pire, on n'aurait jamais dû exister...
https://www.neozone.org/science/pour-les-scientifiques-du-cern-lunivers-ne-devrait-tout-simplement-pas-exister/- edit dans l'edit:
- J'ai mis cet article parce qu'il est facile à comprendre, mais les mots sont imprécis.
Le big bang n'est pas une explosion (ce serait même plutôt une implosion)
et la phrase "Sauf que ce n’est pas le cas vu qu’il existe davantage d’antimatière que de matière" est à inverser : c'est la matière qui a gagné sur l'antimatière.
Si la symétrie de paires de particules matière-antimatière avait été respectée, il n'y aurait pas eu explosion, la matière ne serait simplement pas sortie de la virtualité de ses fluctuations quantiques....
Que la science ne puisse jamais faire la lumière sur la cause première ne me dérange pas. Ce qui me dérange, c'est le flou des définitions du hasard en sciences et de l'existence de (ou dans ?) l'univers physique. alors que plein de monde semble s'en satisfaire...
Donc, si "par hasard" (mais là je ne parle pas d'équiprobabilité) tu trouvais des infos sur ces concepts, j'aimerais bien que tu les partages...
Dernière édition par horizon artificiel le Dim 23 Mai 2021 - 23:46, édité 1 fois (Raison : édition dans l'édition : précision sur l'article fourni)

horizon artificiel- Messages : 3320
Date d'inscription : 23/01/2020
Localisation : Sur Terre depuis le 30 Juin 1966, plus précisément dans les Hauts-de-France, même si apparemment pour certains, je ne serais pas conforme à une prétendue "identité nationale culturelle française"..... Je ne participe plus aux échanges publics sur zc. Changement d'avatar en mai 2022 : j'ai abandonné le fond diffus cosmologique pour rendre hommage à Shireen, Allah i rahma
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
À qui y verrait un intérêt, le premier message a pas mal bougé depuis vendredi !
Je crois avoir plus ou moins réussi à faire le pont jusqu'à la version 1 du tableau périodique de Mendeleïev.
Quelques liens que j'ai trouvé sympas en passant (dont celui de horizon artificiel ci-dessus) :
https://culturesciences.chimie.ens.fr/thematiques/histoire-de-la-chimie/la-classification-periodique-de-lavoisier-a-mendeleiev
http://histoirechimie.free.fr/chap10.htm
http://histoires-de-sciences.over-blog.fr/tag/chimie/
Il y a des passages sur lesquels je garde une note d'inachevé comme la théorie de la valence, comment ils avaient déterminé le volume atomique, et l'identification précises des propriétés similaires qui a permis de détecter et de ranger dans les bonnes cases du tableau etc.
Je vais rester la dessus encore un peu et après une pause car la prochaine étape ce serait dualité onde/particule, Bohr, Planck et compagnie. Ouch
Sinon merci horizon artificiel pour ton retour. Déjà, j'y connais trop rien non plus (à part les bribes dont je me rappelle de l'école), et donc il y a de grandes chances que j'écrive plein d’âneries.
Je t'avoue que j'ose pas trop lire dans le détails ce que tu as écrit car sinon ça va encore me faire partir sur plein de questions et j'ai déjà du mal à rester focalisé en ce moment.
Mais si tu restes dans le fil, je devrais bien finir par passer par des considérations toutes plus naïves les unes que les autres, qui naturellement vont aller vers l'aspect philosophique du bazar. Stay tuned et on en recause dans quelques mois si tu veux bien, mais oui j'essayerai de garder tes demandes en tête et de faire tourner si je trouve des trucs en ce sens
Je crois avoir plus ou moins réussi à faire le pont jusqu'à la version 1 du tableau périodique de Mendeleïev.
Quelques liens que j'ai trouvé sympas en passant (dont celui de horizon artificiel ci-dessus) :
https://culturesciences.chimie.ens.fr/thematiques/histoire-de-la-chimie/la-classification-periodique-de-lavoisier-a-mendeleiev
http://histoirechimie.free.fr/chap10.htm
http://histoires-de-sciences.over-blog.fr/tag/chimie/
Il y a des passages sur lesquels je garde une note d'inachevé comme la théorie de la valence, comment ils avaient déterminé le volume atomique, et l'identification précises des propriétés similaires qui a permis de détecter et de ranger dans les bonnes cases du tableau etc.
Je vais rester la dessus encore un peu et après une pause car la prochaine étape ce serait dualité onde/particule, Bohr, Planck et compagnie. Ouch

Sinon merci horizon artificiel pour ton retour. Déjà, j'y connais trop rien non plus (à part les bribes dont je me rappelle de l'école), et donc il y a de grandes chances que j'écrive plein d’âneries.
Je t'avoue que j'ose pas trop lire dans le détails ce que tu as écrit car sinon ça va encore me faire partir sur plein de questions et j'ai déjà du mal à rester focalisé en ce moment.
Mais si tu restes dans le fil, je devrais bien finir par passer par des considérations toutes plus naïves les unes que les autres, qui naturellement vont aller vers l'aspect philosophique du bazar. Stay tuned et on en recause dans quelques mois si tu veux bien, mais oui j'essayerai de garder tes demandes en tête et de faire tourner si je trouve des trucs en ce sens

Dernière édition par stv82 le Dim 23 Mai 2021 - 21:18, édité 1 fois
stv82- Messages : 501
Date d'inscription : 28/01/2015
Localisation : Alpes du Nord
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Merci pour ton retour.
Suis ton chemin sans perdre ton propre fil, et si il croise mes interrogations, alors on se reparlera à ce moment là
Suis ton chemin sans perdre ton propre fil, et si il croise mes interrogations, alors on se reparlera à ce moment là

horizon artificiel- Messages : 3320
Date d'inscription : 23/01/2020
Localisation : Sur Terre depuis le 30 Juin 1966, plus précisément dans les Hauts-de-France, même si apparemment pour certains, je ne serais pas conforme à une prétendue "identité nationale culturelle française"..... Je ne participe plus aux échanges publics sur zc. Changement d'avatar en mai 2022 : j'ai abandonné le fond diffus cosmologique pour rendre hommage à Shireen, Allah i rahma
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Concernant cette histoire de volume atomique, j'avais demandé sur le discord de Zebra, et les réponses pointaient vers la densité.
J'ai donc demandé sur un site qui permet de poser des questions autour de l'histoire des sciences (c'est en anglais, ici). Le gars qui a répondu est allé regarder le papier original en allemand (tiens d'ailleurs j'ai découvert le site Hathi Trust en passantmême si je n'ai pas été fichu de retrouver le papier dont il parle)
https://babel.hathitrust.org/cgi/pt?id=uc1.c036242860&view=1up&seq=371
Effectivement, on a en général densité = masse / volume, soit en particulier
densité = masseAtomique / volumeAtomique
volumeAtomique = masseAtomique / densité
Si on a la densité des éléments, c'est gagné.
Maintenant, il s'agirait de savoir comment on fait pour refroidir les gaz suffisamment pour en faire des solides comme apparemment la comparaison se serait faite dans l'état solide (sauf pour le chlore). Suite au prochain numéro.
J'ai donc demandé sur un site qui permet de poser des questions autour de l'histoire des sciences (c'est en anglais, ici). Le gars qui a répondu est allé regarder le papier original en allemand (tiens d'ailleurs j'ai découvert le site Hathi Trust en passant
https://babel.hathitrust.org/cgi/pt?id=uc1.c036242860&view=1up&seq=371
Die Natur der chemischen Elemente als Function ihrer Atomgewichte; von Lothar Meyer a écrit:L'une des propriétés qui change assez régulièrement avec le poids atomique est le remplissage spatial des éléments, le volume atomique. Le tableau III donne une représentation graphique de ses variations en fonction des variations des poids atomiques. En abscisses de la courbe sont portées les hauteurs proportionnelles aux poids atomiques, en ordonnées celles qui sont proportionnelles aux volumes atomiques correspondants des éléments à l'état solide (à l'état liquide seulement pour le chlore), c'est-à-dire les quotients du poids atomique et de la densité. Le poids atomique de l'hydrogène et la densité de l'eau sont utilisés comme unités.
Effectivement, on a en général densité = masse / volume, soit en particulier
densité = masseAtomique / volumeAtomique
volumeAtomique = masseAtomique / densité
Si on a la densité des éléments, c'est gagné.
Maintenant, il s'agirait de savoir comment on fait pour refroidir les gaz suffisamment pour en faire des solides comme apparemment la comparaison se serait faite dans l'état solide (sauf pour le chlore). Suite au prochain numéro.
Dernière édition par stv82 le Sam 29 Mai 2021 - 21:14, édité 2 fois
stv82- Messages : 501
Date d'inscription : 28/01/2015
Localisation : Alpes du Nord
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
à quand une présentation en vidéo? :p
Sylph- Messages : 249
Date d'inscription : 20/04/2021
 Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Re: Étapes vers l'infiniment petit (monde macroscopique → moléculaire → atomique → subatomique)
Une vidéo ? Je peux pas, je suis trop moche, et cela ferait baisser les standards de perfection de notre société. Et puis faut faire du montage et tout, c'est trop relou 
Bon sinon, si quelqu'un est intéressé par la vision de Meyer, j'ai enfin pris le temps de traduire (auto) l'article ci-dessus. Je trouve qu'il a vraiment bien synthétisé. Je ne sais pas si les articles scientifiques sont toujours de cette qualité mais c'est plutôt agréable à lire ! Et il semble vachement humble, pas comme ce pignoufe de Lord Kelvin qui avait tout vu, tout compris, le reste c'était juste améliorer des précisions qu'il disait. Ouais ouais ouais.
Bon comme attendu, en fait la gauche du tableau n'était pas super super connu. Du coup, c'était probablement pas en refroidissant qu'ils avaient chopé les densités, mais bien par les gaz plutôt :
L'article complet en français (il doit rester des pépins de traduction)

Bon sinon, si quelqu'un est intéressé par la vision de Meyer, j'ai enfin pris le temps de traduire (auto) l'article ci-dessus. Je trouve qu'il a vraiment bien synthétisé. Je ne sais pas si les articles scientifiques sont toujours de cette qualité mais c'est plutôt agréable à lire ! Et il semble vachement humble, pas comme ce pignoufe de Lord Kelvin qui avait tout vu, tout compris, le reste c'était juste améliorer des précisions qu'il disait. Ouais ouais ouais.
Bon comme attendu, en fait la gauche du tableau n'était pas super super connu. Du coup, c'était probablement pas en refroidissant qu'ils avaient chopé les densités, mais bien par les gaz plutôt :
Meyer a écrit:Comme les volumes atomiques de H, N, O, F et Ti à l'état solide sont inconnus, la section I. et la seconde moitié de II. restent indéterminées à l'avance. D'après le volume moléculaire des trois premiers de ces éléments à l'état gazeux, déterminé par transpiration (Ann. Chem. Pharm. 1867, Supplem. V, 129 if.), et d'après celui des composés solides du fluor et du titane, comparé à celui des substances apparentées, on peut cependant conclure avec un assez bon degré de certitude que la courbe des volumes atomiques des éléments à l'état solide dans la première et la deuxième section aura approximativement le tracé tracé de Pl. III. Il en va de même pour la fin de la section V et le début de la VI, entre lesquels la courbe atteindra sans doute un maximum en Cs.
[...]
Si ces régularités et d'autres semblables ne peuvent pas être de purs jeux de hasard, nous devons d'autre part admettre qu'avec l'étude empirique de ces régularités, nous n'avons nullement trouvé la clé de la connaissance de leur lien causal interne. Mais au moins un point de départ semble avoir été obtenu pour l'étude de la constitution des atomes non encore décomposés, une ligne directrice pour une étude comparative ultérieure des éléments.
Il serait prématuré de modifier les poids atomiques supposés jusqu'à présent sur la base d'indications aussi incertaines. En général, il ne faut pas accorder trop de poids à des arguments de ce genre, ni en attendre une décision aussi certaine que celle que peut donner la détermination de la chaleur spécifique ou de la densité de vapeur. Mais ils peuvent même maintenant attirer notre attention sur des hypothèses douteuses et incertaines, et nous inviter à un nouvel examen de celles-ci. Cet examen servira encore, rétrospectivement, à épurer et à étendre les maigres débuts de notre connaissance des atomes.
L'article complet en français (il doit rester des pépins de traduction)
- La nature des éléments chimiques comme fonction de leurs poids atomiques; par Lothar Meyer:
- Que les éléments chimiques non décomposés jusqu'à présent soient des substances absolument indécomposables est au moins très peu probable à l'heure actuelle. Il semble plutôt que les atomes des éléments ne soient pas les derniers, mais seulement les constituants les plus proches des molécules des éléments et des composés, que les molécules doivent être considérées comme des particules de masse du premier ordre, les atomes comme tels du second ordre, qui à leur tour seront constitués de particules de masse d'un troisième ordre supérieur.
La nature de ces parties constitutives des atomes, même sans une décomposition analytique de ces derniers, a été tentée très tôt après l'acceptation générale de la théorie atomique de Dalton. L'hypothèse de Prout, selon laquelle l'atome d'hydrogène devrait être le composant commun des atomes, sinon de tous, du moins de nombreux éléments, n'a cependant pas trouvé la confirmation présumée par l'expérience. Cela a montré que les valeurs numériques des poids atomiques ne sont pas, en règle générale, des multiples exacts du poids atomique de l'hydrogène, comme le présuppose cette hypothèse.
Lorsque, plus tard, en chimie organique, la systématique des séries a été réalisée avec un si grand succès (S. Gmelin's Handb ., 5th ed., I, p. 48), on a trouvé une analogie entre celles-ci et les poids moléculaires des composés organiques dans les régularités des valeurs numériques des poids atomiques des éléments apparentés, qui avaient déjà été remarquées à un stade précoce, selon lesquelles ces derniers, comme ceux-là, apparaissaient comme des parties composées de masse. Des considérations de ce type ont été publiées par Pettenkofer, Dumas et d'autres (pour la littérature, je renvoie à l'article "Poids atomiques" dans les deux volumes de registre du rapport annuel de la chimie).
Les relations régulières entre les valeurs numériques des poids atomiques ont été recherchées par divers auteurs non seulement entre des éléments très différents, mais aussi présentées de manière très différente. Comme les poids atomiques déterminés selon les règles d'Avogadro et de Dulong et Petit ont été pris comme base de considération au lieu des soi-disant équivalents de Gmelin, la représentation de ces régularités a été considérablement simplifiée. Dès 1864, j'ai pu réunir sous un seul et même schéma les régularités constatées jusqu'alors dans les différentes familles d'éléments chimiques (Die modernen Theorien der Chemie p. 137.). Grâce à une détermination plus correcte des différents poids atomiques, il est devenu possible depuis lors de classer sous le même schéma tous les éléments suffisamment connus jusqu'à présent. Récemment, Mendelejeff a montré (Zeitschr. f. Chem . 1869, No. 13, $. 405.) qu'un tel arrangement peut être obtenu simplement en classant les poids atomiques de tous les éléments dans une seule série, sans sélection arbitraire, selon la taille de leurs valeurs numériques, en divisant cette série en sections, et en réunissant celles-ci dans une séquence inchangée. Le tableau ci-dessous est essentiellement identique à celui donné par Mendelejeff.
Le tableau contient, par ordre croissant de poids atomique, à la seule exception de l'hydrogène qui semble revendiquer une position exceptionnelle, tous les éléments dont le poids atomique a été déterminé jusqu'à présent à partir de la densité gazeuse de leurs composés ou de leur capacité thermique, ainsi que Be et In dont le poids atomique est vraisemblablement dérivé du poids équivalent de A, soit 56 éléments au total. A l'exception de H, il ne manque que Y, Eb, (Tb ?), Ce, La, Di, Th, U, Jg (Jargonium), pour lesquels le poids atomique, et pour certains même le poids équivalent, est inconnu. D'autres lacunes seront peut-être comblées par des éléments qui seront découverts ultérieurement ; peut-être aussi, par des découvertes futures, l'un ou l'autre élément sera-t-il déplacé de sa place et remplacé par un autre mieux adapté.
Alors qu'à travers les neuf séries verticales, de la première à la dernière, les éléments progressent selon la taille des poids atomiques, les séries horizontales contiennent des familles naturelles. Pour obtenir cet arrangement, il suffit de réarranger quelque peu quelques éléments, dont les poids atomiques se sont révélés presque égaux et ne peuvent être considérés comme très certainement déterminés, le tellure avant l'iode, l'osmium avant l'iridium et le platine et ceux-ci avant l'or. Des recherches ultérieures permettront de déterminer si ce réarrangement correspond à l'ordre des poids atomiques correctement déterminés.
Aux remarques que Mendelejeff fait sur son tableau, je n'ajouterai ici que celle que les éléments des séries verticales IV, VI et VIII sont souvent reliés par isomorphisme à ceux des séries horizontales immédiatement précédentes, ainsi Ti et Zr avec Si, V avec P, Cr et Mo avec S, Mn avec Ci, Ag avec Na, Zn avec Mg, et ainsi de suite.
Pour la question de la composition possible des atomes jusqu'ici non décomposés, le tableau p. 356 illustre particulièrement une conclusion importante. Si nous partons de l'hypothèse que les atomes sont des agrégats d'une seule et même matière et qu'ils ne diffèrent que par leurs différentes masses, nous pouvons alors considérer les propriétés des éléments dans leur dépendance à l'égard de la taille de leur poids atomique, et les représenter précisément comme des fonctions du poids atomique. Dans cette optique, nous déduisons du tableau que les propriétés des éléments sont en grande partie des fonctions périodiques du poids atomique. Les mêmes propriétés ou des propriétés similaires réapparaissent lorsque le poids atomique a augmenté d'une certaine magnitude, qui est d'abord de 16, puis d'environ 46, et enfin de 88 à 92 unités. Ceci est vrai dans tous les cas, quel que soit l'élément à partir duquel on part.
Aussi frappante et séduisante que soit cette remarque, elle nous laisse complètement dans l'ignorance du changement de propriétés à l'intérieur de la période, à la fin de laquelle reviennent les propriétés qui existaient au début. Si, par exemple, nous partons de Li, après une augmentation de près de 16 unités, nous trouvons ses propriétés les plus essentielles dans Na , et après 16 autres unités dans Ka ; sur le chemin, cependant, nous rencontrons dans la série la plus colorée d'abord les éléments Be, B, C, N, 0, F, puis à nouveau Mg, Al, Si, P, S, CI, apparemment sans aucune médiation des transitions. Seule la capacité de saturation des atomes augmente et diminue régulièrement et également dans les deux intervalles :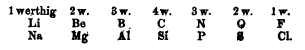
Mais si l'on veut représenter la nature des éléments dans leur dépendance à l'égard de la grandeur de leur poids atomique, il faut suivre pas à pas le changement de chaque propriété d'élément à élément. Les considérations qui suivent ont pour but de fournir un point de départ à cet égard.
Une des propriétés qui change assez régulièrement avec le poids atomique est le remplissage de l'espace par les éléments, le volume atomique. Le tableau III donne une représentation graphique de ses variations en fonction des variations des poids atomiques. En abscisses d'une courbe sont portées les longueurs proportionnelles aux poids atomiques, en ordonnées celles qui sont proportionnelles aux volumes atomiques correspondants des éléments à l'état solide (seulement pour le chlore à l'état liquide), c'est-à-dire les quotients du poids atomique et de la densité. Le poids atomique de l'hydrogène et la densité de l'eau sont pris en unités. Les points extrêmes des ordonnées successives ont été reliés par une courbe continue, afin de faire apparaître plus clairement les changements que subit le volume atomique avec l'augmentation du poids atomique. Lorsque la connaissance du volume atomique d'un ou de plusieurs éléments fait défaut, la courbe est tracée en pointillés, et les symboles atomiques des éléments qui s'y trouvent sont indiqués en italique, sinon en lettres majuscules.
A partir du tracé de la courbe, on voit tout de suite que le remplissage de l'espace des éléments, comme leur comportement chimique, est une fonction périodique de la taille de leur poids atomique. Lorsque le poids atomique augmente, le volume atomique diminue et augmente régulièrement. La courbe qui représente ses changements est divisée par cinq maxima en six sections, qui présentent approximativement la forme de lignes de chaîne enfilées, dont la deuxième et la troisième ainsi que la quatrième et la cinquième sont assez semblables entre elles et correspondent à des morceaux presque identiques de l'axe des abscisses.
Comme les volumes atomiques de H, N, O, F et Ti à l'état solide sont inconnus, la section I. et la seconde moitié de II. restent indéterminées à l'avance. D'après le volume moléculaire des trois premiers de ces éléments à l'état gazeux, déterminé par transpiration (Ann. Chem. Pharm. 1867, Supplem. V, 129 if.), et d'après celui des composés solides du fluor et du titane, comparé à celui des substances apparentées, on peut cependant conclure avec un assez bon degré de certitude que la courbe des volumes atomiques des éléments à l'état solide dans la première et la deuxième section aura approximativement le tracé tracé de Pl. III. Il en va de même pour la fin de la section V et le début de la VI, entre lesquels la courbe atteindra sans doute un maximum en Cs.
Si nous regardons maintenant la position des éléments sur la courbe, nous trouvons des éléments avec des propriétés similaires à des points correspondants sur les parties similaires de la courbe. Le fait que les maxima de la courbe soient formés par des métaux légers, et les trois derniers minima par des métaux lourds, n'est pas particulièrement notable, puisque nous savons depuis longtemps que les
premiers ont des volumes atomiques très grands et les seconds très petits. Mais très remarquable, il apparaît que même avec un volume atomique identique ou presque identique, les propriétés sont très différentes, selon que l'élément se trouve sur une branche montante ou descendante de la courbe, selon qu'il a un volume atomique plus petit ou plus grand que l'élément ayant le poids atomique immédiatement supérieur. Sur le graphique. III. Ces différences sont en partie indiquées par des mots inscrits individuellement. On les trouve régulièrement dans certaines parties de toutes les courbes, et dans d'autres seulement dans les sections des courbes qui se correspondent par paires.
Tous les éléments légèrement liquides, volatils et gazeux se trouvent sur les branches ascendantes de la courbe ; les éléments strictement liquides, par contre, en II. et II. au minimum ou près du minimum, en IV., V., VI. sur les branches descendantes, et ceux qui sont particulièrement difficiles à fondre sur celles-ci près du minimum. Les éléments, donc, dont les molécules se séparent facilement
les unes des autres, sont ceux qui augmenteraient leur volume s'ils pouvaient passer dans l'élément suivant en augmentant leur poids atomique. En revanche, les éléments qui diminueraient leur volume atomique s'il était possible de les transformer en premier élément en augmentant leur poids atomique sont strictement liquides et peu volatils.
Les métaux ductiles se situent : les légers, dans les points maximaux et les parties de la courbe qui les suivent immédiatement ; les lourds, dans les points minimaux des sections IV, V et VI et les parties de la courbe qui en découlent. Les métaux lourds fragiles se trouvent en IV. et V. et probablement aussi en VI. (si les poids atomiques de Ir et Os sont un peu plus petits qu'on ne le suppose actuellement) juste avant le minimum sur la courbe descendante. Fragiles et non métalliques sont également les éléments sur toutes les parties ascendantes de la courbe précédant le maximum.
Le comportement électrochimique change régulièrement en II. et Ill. une fois chacun, en IV., V. et VI. deux fois chacun. Dans ces dernières, les éléments sont positifs sur la courbe descendante, négatifs sur la courbe ascendante ; dans ces sections, les plus grandes, ils sont positifs au maximum et au minimum, et d'abord après les deux, mais négatif juste avant le minimum et le maximum.
La règle de Dulong et Petit pour la chaleur spécifique s'applique à tous les éléments, à l'exception de ceux qui sont proches du minimum en I., II. et III. Ceux-ci peuvent être séparés des autres par une ligne droite tracée en Taf. III. des autres. Ils se tiennent tous en dessous.
Si ces régularités et d'autres semblables ne peuvent pas être de purs jeux de hasard, nous devons d'autre part admettre qu'avec l'étude empirique de ces régularités, nous n'avons nullement trouvé la clé de la connaissance de leur lien causal interne. Mais au moins un point de départ semble avoir été obtenu pour l'étude de la constitution des atomes non encore décomposés, une ligne directrice pour une étude comparative ultérieure des éléments.
Les maigres débuts actuels sont déjà capables de quelques applications. Ils peuvent être utilisés, par exemple, pour vérifier un poids atomique trouvé ou pour en déterminer un pour des éléments dont l'équivalent et la densité sont connus, mais dont la capacité thermique n'est pas encore déterminée. Si le volume atomique correspondant au poids atomique trouvé ne se situe pas dans le tracé régulier de la courbe, une erreur de détermination est probable. Ainsi, les poids atomiques du tellar, du platine, de l'iridium et de l'osmium sont probablement un peu trop élevés, comme l'a déjà conclu le tableau de la page 356.
L'équivalent de l'indium, d'après les déterminations plus récentes de Cl. Winkler (Journ. für pract. Chem. XCII, 480.), qui concordent tout à fait avec celles de Reich et Richter (Daselbst CII, 282.), est In = 37.8. Comme la densité du métal a été trouvée = 7.42, le volume équivalent suit 5.1. Ce ne peut être le volume atomique, car il se trouverait entièrement en dehors de la courbe. Si l'on suppose que In
= 75,6 divalent, il se situe alors entre As et Se, où le métal électropositif ductile pafst aussi peu que le volume atomique correspondant 10,2 au cours de la courbe. Si, par contre, on fixe In = 3 x 37,8 = 113,4, comme Al apparemment trivalent, en fait tétravalent, il se situe entre Cd et Sn avec le volume atomique = 15,3, ce qui s'inscrit assez bien dans la courbe.
Des considérations similaires montrent que ni le poids atomique U = 60 ni U = 120 ne sont compatibles avec la densité = 18,4 trouvée pour l'uranium métal (Peligot, 1856, Compt. rend. XLII, 73.), mais U = 180 avec le volume atomique 9,8, proche de celui du tungstène. En supposant ce poids atomique, l'oxyde noir deviendrait U2O3, le vert UO2, (Regnault en 1840 a trouvé la chaleur spécifique de l'oxyde noir alors pris pour le métal = 0,062, pour U = 180 cela devient la chaleur moléculaire = 0,062. U2O3 = 25,3 presque en accord avec celle de Fe2O3, Cr2O3, As2O3, Sb2O3, et Bi2O3. S. Ann . Chimie . Pharm ., Suppl. III, 294.).
D'autres cas présentent des preuves moins évidentes.
Pour le cérium, par exemple, dont la chaleur spécifique et le poids atomique n'ont pas encore été déterminés, diverses hypothèses possibles sont faites concernant les volumes atomiques qui s'adaptent dans une certaine mesure à la courbe. Si la densité du métal pur est la même que celle déterminée par Wöhler (Ann. Chem. Pharm . 1867, CXLIV, 253.) pour un petit morceau du métal considéré comme pas tout à fait pur, alors l'équivalent Ce = 46 a un volume de 8,4, ce qui ne semble pas correspondre à la courbe. Ce = 92, avec un volume de 16,7, y trouverait sa place, mais le métal ductile se situerait entre Zr et Nb. Il est frappant de constater qu'aucun multiple de l'équivalent ne se situe dans l'un des intervalles dans lesquels se trouvent les poids atomiques de tous les autres métaux ductiles. Il est concevable que les oxydes et les sels de cérium contenaient plus d'oxygène que nous le supposons.
Il serait prématuré de modifier les poids atomiques supposés jusqu'à présent sur la base d'indications aussi incertaines. En général, il ne faut pas accorder trop de poids à des arguments de ce genre, ni en attendre une décision aussi certaine que celle que peut donner la détermination de la chaleur spécifique ou de la densité de vapeur. Mais ils peuvent même maintenant attirer notre attention sur des hypothèses douteuses et incertaines, et nous inviter à un nouvel examen de celles-ci. Cet examen servira encore, rétrospectivement, à épurer et à étendre les maigres débuts de notre connaissance des atomes.
Carlsruhe, décembre 1869.
stv82- Messages : 501
Date d'inscription : 28/01/2015
Localisation : Alpes du Nord
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum
 Évènements
Évènements